Glosario de términos
Última actualización: 2026-02-06 | Mejora esta página
Teoría epidémica y modelos
- Modelo Matemático de Enfermedades Infecciosas
-
Un modelo matemático en la teoría epidémica de enfermedades infecciosas es una representación abstracta que utiliza ecuaciones matemáticas y algoritmos para describir la dinámica de la propagación de infecciones dentro de una población. Estos modelos permiten comprender, predecir o proyectar cómo una enfermedad infecciosa puede propagarse y afectar a una comunidad, considerando diversos factores como la tasa de transmisión, el período infeccioso, la recuperación y la inmunidad.
El clásico modelo matemático es el modelo SIR: Susceptible, Infeccioso y Recuperado. Este tradicionalmente hace uso de ecuaciones diferenciales ordinarias (ODEs)-
Hay varios tipos de modelos matemáticos, los más comunes son: deterministas y estocásticos
- Ecuaciones Diferenciales Ordinarias
-
Las ecuaciones diferenciales ordinarias (ODEs) se pueden usar para representar la tasa de cambio de una variable (por ejemplo, el número de individuos infectados) con respecto a otra (por ejemplo, el tiempo). Las ODEs se utilizan ampliamente en la modelización de enfermedades infecciosas para modelar el flujo de individuos entre diferentes estados de la enfermedad.
Para profundizar en el tema consulte esta introducción a las ODEs.
- Modelo Determinista
-
Un modelo determinista es un tipo de modelo matemático en el cual el comportamiento del sistema está completamente determinado por sus condiciones iniciales y los parámetros del modelo, sin involucrar elementos de aleatoriedad o incertidumbre. En otras palabras, dado un conjunto de condiciones iniciales y parámetros, el modelo siempre producirá el mismo resultados.
- Modelo Estocástico
-
Un modelo estocástico aborda la variación aleatoria de los parámetros en las simulaciones del modelo para las mismas condiciones iniciales. Esto significa que no siempre se van a obtener exactamente los mismos resultados en todas las simulaciones. Ejemplos incluyen ecuaciones diferenciales estocásticas y modelos de procesos de ramificación. Para más detalles, consulta Allen (2017).
- Condiciones iniciales
-
En las Ecuaciones Diferenciales Ordinarias (ODEs por sus siglas en inglés de Ordinary differential equations), las condiciones iniciales son los valores de cada compartimento en el tiempo inicial del modelo (tiempo cero). Estas condiciones son necesarias para iniciar la simulación de la epidemia en el modelo y pueden afectar significativamente los resultados posteriores.
Ejemplo: Si hay un individuo infeccioso en una población de 1000 en un modelo Susceptible-Infeccioso-Recuperado, las condiciones iniciales serían
\(S_0=999\)
\(I_0=1\)
\(R_0=0\)
- Parámetros de los modelos de transmisión
-
Los parámetros del modelo son valores que permiten el movimiento de los individuos entre los diferentes compartimentos; describen el flujo entre estados de enfermedad. Estos incluyen, por ejemplo: la tasa de recuperación la cual es un parámetro del modelo que se puede usar para describir el flujo entre estados infecciosos y recuperados.
- Variables de estado
-
Las variables de estado en un modelo representado por ecuaciones diferenciales ordinarias son los estados de la enfermedad en los que los individuos pueden estar. Por ejemplo, si los individuos pueden ser susceptibles, infecciosos o recuperados, las variables de estado son S, I y R. Hay una ecuación diferencial ordinaria para cada variable de estado.
- Susceptible
-
Población sin exposición previa ni actual al patógeno, o sin vacunación y que por lo tanto no tiene infección ni tampoco protección inmunológica humoral (anticuerpos neutralizantes) contra el patógeno. (Relacionado a variables de estado)
Ejemplos
En 2020, al inicio de la pandemia por COVID-19, toda la población mundial se consideraba susceptible.
Niños no vacunados contra sarampión y que tampoco han estado infectados o no han desarrollado anticuerpos post-infección.
- Infeccioso
-
Población que tiene presencia activa del patógeno con capacidad de transmitirlo a los individuos susceptibles de la población. Este estado tiene una duración equivalente al periodo infeccioso.
Ejemplo
- Paciente que convive con VIH sin recibir tratamiento antirretroviral con alta carga viral que sostiene relaciones sexuales sin preservativo.
- Recuperado
-
Población con anticuerpos neutralizantes frente al patógeno. Esta inmunidad pudo haber sido adquirida vía infección natural o vía vacunación. Este estado tiene una duración equivalente al periodo de duración de la inmunidad neutralizante. (Relacionado a variables de estado)
Ejemplo
- Persona vacunada frente a fiebre amarilla. Esta vacuna tiene una alta protección de larga duración frente a la infección.
- Expuesto
-
Población que ha sido contagiada con un patógeno pero que aún no es capaz de transmitir la infección (infectado, pero no infeccioso). Este estado tiene una duración equivalente al periodo de latencia.
Ejemplo
- La transmisión del bacilo de la tuberculosis se da a partir de sujetos bacilíferos positivos que emiten bacilos al medio y los individuos expuestos suelen contagiarse con facilidad. Sin embargo, durante muchos años los individuos pueden permanecer infectados, pero controlando la enfermedad, sin transmitirla, estos individuos son considerados expuestos en los modelos dinámicos de transmisión.
- Spillover
-
En epidemiología, el término spillover se refiere al proceso por el cual un patógeno (microorganismo, ya sea virus, bacteria, parásito u otro), que normalmente afecta a una especie animal específica, se transmite a otro reservorio. En otras palabras, es el salto evolutivo de un patógeno entre especies, lo cual incluye la transmisión de un animal a un humano.
- Zoonosis
-
La OPS define zoonosis como “enfermedades infecciosas transmisibles naturalmente desde animales vertebrados al ser humano”.
Parámetros de Transmisión
- Número de reproducción básico, R0
-
Se define como el número promedio de casos secundarios que se producen a partir de un caso primario en una población totalmente susceptible, es decir, en el tiempo 0. Este número es propio de cada agente infeccioso, aunque también se puede ver afectado por variables climáticas y sociales, y representa el potencial de transmisión que tiene el patógeno. Este valor es teórico y también determina el umbral de la inmunidad de rebaño. Es una medida de la transmisibilidad de una infección. Se calcula como:
\(R0 = p * c * D\)
Donde,
\(p\) = probabilidad de infección posterior al contacto
\(c\)= tasa de contactos
\(D\) = duración del periodo infeccioso
Ejemplo
-
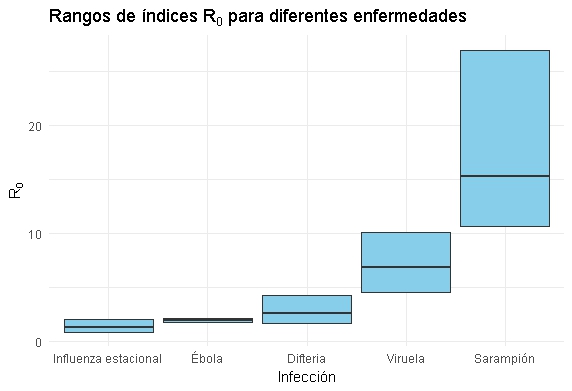
En el siguiente diagrama se compara el \(R_0\) del síndrome respiratorio de la Influenza estacional, Ébola, Difteria, Viruela y Sarampión.
- Número de reproducción efectivo,\(R_t\)
-
Se define como el número promedio de casos secundarios a partir de un caso infeccioso en la población compuesta por huéspedes susceptibles y no susceptibles por unidad de tiempo (t). Se calcula así:
\(R_t = R_0 * S\)
Donde:
\(R_0\) = Número básico de reproducción
\(S\) = proporción de susceptibles en la población
Características del Número de Reproducción Efectivo, \(R_t\):
Temporal: \(R_t\) refleja la situación actual de la transmisión de la enfermedad y cambia con el tiempo.
Contextual: A diferencia de \(R_0\), que asume una población completamente susceptible, R(t) considera el impacto de la inmunidad adquirida (por infección o vacunación) y las intervenciones de salud pública (como el distanciamiento social, cuarentenas y uso de mascarillas).
Interpretación:
\(R_t >1\): La infección se está propagando en la población.
\(R_t =1\) : La infección se mantiene estable en la población.
\(R_t < 1\) : La infección está disminuyendo y eventualmente puede desaparecer.
El \(R_t\) puede estar influenciado por dos grandes grupos de factores:
Medidas de control: medicamentos antimicrobianos, medidas de barrera (preservativo, tapabocas), y medidas de reducción de contacto (aislamiento, distanciamiento, uso de mosquiteros, fumigación, etc)
Adquisición de inmunidad mediante anticuerpos neutralizantes (reducción de susceptibles a medida que avanza una epidemia o vacunación).
- Tasa de contacto
-
La tasa de contacto es una medida epidemiológica que describe la frecuencia con la que los individuos de una población entran en contacto unos con otros, en un periodo de tiempo específico, de manera que existe la posibilidad de transmisión de una enfermedad infecciosa. Esta tasa es fundamental para entender y modelar la dinámica de la propagación de enfermedades dentro de una comunidad.
Características de la Tasa de Contacto:
Frecuencia: Refleja el número de contactos potencialmente infecciosos por individuo en un periodo de tiempo determinado.
Homogénea vs Heterogénea: La tasa de contacto puede ser homogénea, si los contactos se distribuyen uniformemente entre todos los individuos, o heterogénea, si algunos individuos tienen más contactos que otros, lo cual es común en la realidad.
Influencia de Factores: La tasa puede variar dependiendo de factores como edad, comportamiento, entorno y medidas de control (por ejemplo, distanciamiento social).
Cálculo de la Tasa de Contacto: La tasa de contacto se puede estimar a partir de datos empíricos recolectados mediante encuestas, estudios observacionales o inferencias a partir de modelos matemáticos.
- Matriz de contacto
-
Una matriz de contacto es una herramienta epidemiológica que representa las tasas de contacto entre diferentes grupos de una población, normalmente organizados por categorías como edad, género o ubicación geográfica. Cada elemento en la matriz indica la frecuencia con la que individuos de un grupo específico tienen contacto con individuos de otro grupo.
Características de la Matriz de Contacto:
Estructura: Es una matriz cuadrada, donde las filas y columnas representan los diferentes grupos de la población.
Elementos: Cada celda de la matriz muestra el número de contactos promedio entre los individuos de los grupos correspondientes.
Datos: Los datos pueden ser recolectados mediante encuestas, estudios observacionales o inferidos a partir de modelos matemáticos.
- Periodo de latencia
-
Intervalo de tiempo entre la exposición a un agente infeccioso con una transmisión exitosa y el inicio del periodo infeccioso. Durante el período de latencia, las personas infectadas no transmiten la infección.
Ejemplos
Para la tuberculosis el periodo de latencia suele ser prolongado, y luego del contagio los individuos permanecen sin transmitir la enfermedad por muchos años.
Para la infección por SARS-CoV-2 el periodo de latencia era corto (2-4 días) y además era más corto que el periodo de incubación, por lo que los individuos podían contagiar la infección antes de la aparición de los síntomas.
- Periodo de incubación
-
Intervalo de tiempo entre la exposición a un agente infeccioso con una transmisión exitosa y el inicio de la enfermedad clínica (signos y síntomas). Para enfermedades en las que el inicio del periodo infeccioso coincide con la aparición de los signos y síntomas, los períodos de latencia y de incubación son los mismos.
Ejemplo
- En el estudio de Wu et al 2022. se realiza una revisión sistemática de los periodos de incubación de SARS-CoV2. Se encuentra que: el período de incubación promedio de COVID-19 fue de 5,00 días (IC del 95%, 4,94-5,06 días) para los casos causados por la variante Alfa, 4,50 días (IC del 95%, 1,83-7,17 días) para la variante Beta, 4,41 días (IC del 95%, 3,76-5,05 días) para la variante Delta y 3,42 días (IC del 95%, 2,88-3,96 días) para la variante Ómicron. Los hallazgos de este estudio sugieren que el SARS-CoV-2 ha evolucionado y mutado continuamente a lo largo de la pandemia de COVID-19, produciendo variantes con diferentes niveles de transmisión y virulencia. Identificar el período de incubación de las diferentes variantes es un factor clave para determinar el período de aislamiento. (Wu et al. 2022)
- Periodo infeccioso
-
Intervalo de tiempo en el que el individuo infectado tiene replicación activa del patógeno y puede transmitirlo a otros individuos. Dado que este período puede superponerse con el período de incubación, puede ser difícil obtener estimaciones precisas del período infeccioso. La carga viral y la detección del virus infeccioso son los dos parámetros clave para estimar la infecciosidad (Puhach et al., 2022 y Hakki et al, 2022).
Ejemplo
- En los casos de virus respiratorios (e.g. influenza, SARS-CoV-2) este periodo puede durar días, mientras que enfermedades como VIH o tuberculosis puede durar años.
- Tiempo de recuperación
-
Intervalo de tiempo que transcurre entre el inicio del periodo infeccioso y el momento en que un individuo deja de transmitir el patógeno.
Ejemplo
- En los casos de varicela, los sujetos dejan de transmitir el patógeno en el momento en que todas las lesiones han formado costras. Por lo tanto, el periodo de recuperación aparece antes de la desaparición de las lesiones. Luego de este periodo los sujetos se consideran recuperados.
- Tiempo generacional
-
Intervalo de tiempo entre el inicio del periodo infeccioso de un caso primario y el inicio del periodo infeccioso en un caso secundario, infectado por el caso primario. Normalmente es desconocido y se hace una aproximación con el intervalo serial. No se puede medir, sólo estimar.
Ejemplo
- El estudio de Hart et al. 2022 en el Reino Unido entre febrero y agosto de 2021, se reclutó 227 hogares con 559 participantes. Se encontró que la variante delta se transmitía más rápido que la variante alfa en los hogares, con un tiempo medio de generación más corto: 4,7 días para la delta frente a 5,5 días para la alfa. Esto sugiere que la delta se propaga más rápidamente en los hogares debido a una rápida disminución de individuos susceptibles, lo que podría hacer que las intervenciones como el rastreo de contactos y el aislamiento sean menos efectivas. (Hart et al. 2022)
- Intervalo Serial
-
Período de tiempo entre el inicio de los síntomas de un caso primario y el inicio de los síntomas en un caso secundario infectado por el caso primario. Es medible dado que se pueden obtener los datos como fechas de la aparición de síntomas. Este valor puede ser negativo cuando ocurre una infección presintomática. La distribución del intervalo serial de una infección se utiliza comúnmente para estimar la distribución del tiempo de generación (Cori et al., 2017). La relación entre el intervalo serial y el período de incubación ayuda a definir el tipo de transmisión de la infección (sintomática o presintomática) (Nishiura et al., 2020)
Ejemplo: en el estudio de Nishuura et al. 2020 se estimó el intervalo serial del COVID-19 a partir de 28 pares de infectores e infectados. Se analizaron las fechas de inicio de la enfermedad de los casos primarios y secundarios, ajustando por truncamiento a la derecha debido a que la epidemia aún estaba en crecimiento. Los resultados mostraron que el intervalo serial mediano fue de 4,0 días en el conjunto completo de datos y de 4,6 días en el subconjunto de pares con mayor certeza. Se concluye que el intervalo serial de COVID-19 es cercano o más corto que su período de incubación, lo que sugiere una transmisión significativa antes del inicio de síntomas, y es más corto que el intervalo serial del SARS, lo que podría introducir sesgos en los cálculos basados en SARS.
- Tasa de Ataque
-
La tasa de ataque es una medida epidemiológica que describe la proporción de personas en una población específica que desarrollan una enfermedad o infección durante un periodo de tiempo definido, generalmente en el contexto de un brote o epidemia. Esta tasa incluye tanto los casos de enfermedad como las infecciones asintomáticas, y puede requerir estudios de seroprevalencia o modelos matemáticos para su cálculo preciso.
Características:
Propósito: Evalúa la proporción de personas que se enferman o se infectan entre los inicialmente expuestos.
Contexto: Utilizada para medir el impacto inmediato de la exposición a un agente infeccioso.
- Tasa Secundaria de Ataque Sintómática
-
La tasa de ataque sintomática mide la proporción de personas expuestas que desarrollan síntomas clínicos de la enfermedad. Se enfoca exclusivamente en aquellos individuos que presentan síntomas, diferenciándose así de la tasa de ataque general que puede incluir casos asintomáticos.
Características:
Propósito: Evalúa la proporción de personas expuestas que desarrollan síntomas clínicos, proporcionando una medida de la manifestación clínica de la enfermedad.
Contexto: Utilizada para entender la gravedad y el impacto clínico de la enfermedad en una población específica.
- Tasa Secundaria de Ataque (Secondary Attack Rate, SAR)
-
La tasa de ataque secundaria mide la proporción de casos que ocurren entre los contactos cercanos de los casos primarios. Se enfoca en la transmisión secundaria de la enfermedad, es decir, la propagación de la enfermedad de los casos iniciales a otros individuos en contacto cercano.
Características:
Propósito: Mide la transmisión de la enfermedad entre contactos cercanos de los casos primarios.
Contexto: Utilizada para evaluar la efectividad de las medidas de control y para entender mejor la dinámica de transmisión de la enfermedad.
- Umbral de Inmunidad de Rebaño
-
El umbral de inmunidad de rebaño es la proporción de la población que debe ser inmune a una enfermedad infecciosa, ya sea a través de vacunación o infección previa, para que la propagación de la enfermedad disminuya y eventualmente se detenga. Cuando se alcanza este umbral, incluso los individuos no inmunes están protegidos indirectamente debido a la reducción de la probabilidad de transmisión del patógeno.
Características del Umbral de Inmunidad de Rebaño:
Proporción Crítica: Representa la fracción de la población que necesita ser inmune para interrumpir la transmisión sostenida de la infección..
Dependencia de R₀: El umbral está directamente relacionado con el número de reproducción básico (R₀) de la infección, que es el número promedio de casos secundarios producidos por un caso primario en una población completamente susceptible.
Cálculo: El umbral de inmunidad de rebaño depende del número de reproducción básica \(R_0\) y se define como \(1 – \frac{1}{R0}\). Mientras más contagioso sea un patógeno, mayor será su \(R_0\) y mayor la proporción de la población que deberá ser inmune para poder bloquear la transmisión en forma sostenida.
Ejemplo
- En el caso de sarampión, para un \(R_0\) de 18, la inmunidad de rebaño es aproximadamente 95%.
- “Overshoot”
-
El término overshoot se refiere al fenómeno en el cual el número de casos de una enfermedad infecciosa supera el umbral de inmunidad de rebaño durante un brote o epidemia, antes de que la transmisión de la enfermedad disminuya y se estabilice. Este exceso de casos ocurre a pesar de que una proporción suficiente de la población ha alcanzado la inmunidad necesaria para frenar la propagación de la enfermedad.
Características del Overshoot:
Exceso de Casos: Ocurre cuando hay más casos de lo esperado incluso después de alcanzar el umbral de inmunidad de rebaño.
Temporal: Es un fenómeno transitorio que se observa antes de que la enfermedad se estabilice o desaparezca.
Inmunidad de Rebaño: Indica que el umbral de inmunidad de rebaño se ha alcanzado pero la transmisión continua inicialmente debido a la dinámica de la epidemia.
Causas del Overshoot:
Inercia Epidémica: La enfermedad sigue propagándose debido a la cantidad de individuos susceptibles que todavía están expuestos al agente infeccioso antes de que la transmisión se reduzca.
Distribución Heterogénea de la Inmunidad: La inmunidad no está uniformemente distribuida en la población, lo que permite que ocurran brotes localizados.
- Tamaño crítico poblacional (Critical Community Size, CCS)
-
Es el tamaño mínimo de una población cerrada que se requiere para que un agente infeccioso persista en esa población. Si el número de la población es muy bajo, luego de un brote el patógeno no puede persistir y desaparece. Esta masa crítica de susceptibles está determinada por las características del agente, por la estructura demográfica y por las condiciones higiénicas de la población de hospederos.
Ejemplo: Para el sarampión, que tiene un R₀ alto, el CCS es relativamente grande. Estudios han mostrado que el sarampión necesita una población de al menos 250,000 a 500,000 individuos para mantenerse endémico. En contraste, enfermedades con un R₀ más bajo pueden tener un CCS mucho menor.
- Superdispersión
-
La superdispersión es un fenómeno en la epidemiología de enfermedades infecciosas donde un pequeño número de individuos infectados es responsable de una gran proporción de las nuevas infecciones. Estos individuos, conocidos como “superpropagadores”, infectan a un número de personas mucho mayor que el promedio esperado, acelerando así la propagación de la enfermedad.
Características de la Superdispersión:
Variabilidad en la Transmisión: Existe una gran heterogeneidad en la capacidad de los individuos para transmitir la enfermedad, con unos pocos individuos causando muchas infecciones mientras que la mayoría causa pocas o ninguna.
Factor de Dispersión (k): El grado de superdispersión se puede cuantificar mediante el parámetro k. Valores bajos de k indican alta superdispersión, mientras que valores cercanos a 1 indican que la dispersión es más uniforme.
Contexto Específico: Los eventos de superdispersión suelen ocurrir en contextos específicos como reuniones masivas, espacios cerrados y actividades donde hay un contacto cercano prolongado.
Ejemplo: Durante la pandemia de COVID-19, se observaron varios eventos de superdispersión, como una sola persona infectada que contagió a decenas de personas en una reunión religiosa en Corea del Sur. En otro caso, un evento de coro en los Estados Unidos resultó en muchas infecciones a partir de un solo individuo infectado.
Ejemplo
- En Corea del Sur durante la pandemia por COVID-19 se produjeron eventos de sobredispersión en el contexto de coros religiosos, con 11 clusters de transmisión asociados a 641 casos de enfermedad por COVID-19.
- Tasa de crecimiento exponencial
-
La tasa de crecimiento exponencial es una medida epidemiológica que describe la velocidad a la cual el número de casos de una enfermedad infecciosa aumenta en una población en el tiempo inicial de una epidemia, cuando las medidas de control no han sido implementadas o son mínimas. Esta tasa es fundamental para entender la dinámica de la propagación de una enfermedad en sus primeras etapas y para planificar intervenciones de salud pública.
Cálculo de la Tasa de Crecimiento Exponencial: La tasa de crecimiento exponencial se puede calcular utilizando la fórmula:
\[r = \frac{\ln(C_t) - \ln(C_0)}{t}\]
Donde:
\(r\) es la tasa de crecimiento exponencial.
\(C_t\) es el número de casos en el tiempo t.
\(C_0\) es el número de casos inicial.
\(t\) es el tiempo transcurrido.
Parámetros de Severidad
- Letalidad
-
Hace referencia a la severidad de la enfermedad con respecto a la muerte. Esta puede ser clasificada con IFR o como CFR.
- Infection Fatality Ratio (IFR)
-
Probabilidad de muerte tras la infección (sintomática o asintomática).
Ejemplo
- Para el SARS-CoV-2, la edad es, con diferencia, el principal factor de riesgo de muerte. Por ello, el IFR promedio de una población, depende de su estructura demográfica.
- Case Fatality Ratio (CFR)
-
Probabilidad de muerte entre los casos reportados. Por lo general sólo incluye casos sintomáticos confirmados por laboratorio o por clínica. Por ello, el CFR siempre será superior que el IFR.
Ejemplo
- El CFR reportado para Ébola se ha estimado en los diferentes brotes entre 30-70%.
- Hospitalisation Fatality Ratio (HFR)
-
El Hospitalisation Fatality Ratio (HFR) es un parámetro epidemiológico que mide la proporción de individuos hospitalizados con una enfermedad específica que fallecen a causa de esa enfermedad. Este ratio es una medida de la gravedad de la enfermedad entre aquellos que requieren hospitalización y proporciona información crucial sobre la eficacia del tratamiento hospitalario y la severidad de la enfermedad en los casos más graves
Sesgos en el reporte de Parámetros
- Sesgo de fase (dinámica o epidémica)
-
Considera la susceptibilidad de la población en los momentos en que se observan los pares de transmisión (casos y contactos). Es un tipo de sesgo de muestreo. Afecta los datos retrospectivos y está relacionado con la fase de la epidemia: durante la fase de crecimiento exponencial, los casos que desarrollaron síntomas recientemente están sobrerrepresentados en los datos observados, mientras que, durante la fase de declive, estos casos están subrepresentados, lo que lleva a la estimación de intervalos de demora más cortos y más largos, respectivamente. (Park et al., en progreso)
- Retraso en el reporte
-
Demora o retraso entre el momento en que ocurre un evento (por ejemplo, la aparición de síntomas) y el momento en que se reporta (Lawless, 1994). Podemos cuantificar comparando la lista de casos con versiones sucesivas de la misma o con los recuentos agregados de casos reportados actualizados (Cori et al., 2017).
- Sesgo de truncamiento derecho
-
Tipo de sesgo de muestreo relacionado con el proceso de recolección de datos. Surge porque solo se pueden observar los casos que han sido reportados. No tener en cuenta el truncamiento derecho durante la fase de crecimiento de una epidemia puede llevar a una subestimación del promedio del retraso (Park et al., en progreso).
- Censura
-
Significa que sabemos que un evento ocurrió, pero no sabemos exactamente cuándo ocurrió. La mayoría de los datos epidemiológicos están “doblemente censurados” porque hay incertidumbre tanto en los tiempos de eventos primarios como secundarios. No tener en cuenta la censura puede llevar a estimaciones sesgadas de la desviación estándar del retraso (Park et al., en progreso). Diferentes enfoques de muestreo pueden generar sesgos debido a la censura a la izquierda y a la derecha en la estimación del intervalo serial, lo que puede propagar el sesgo a la estimación del período de incubación y el tiempo de generación (Chen et al., 2022).
Riesgos Relativos
- Risk Ratio (RR)
-
La medida Risk Ratio (RR) también llamada Razón de riesgo o riesgo relativo, compara el riesgo de desarrollar un evento de salud (enfermedad, muerte) entre dos grupos Lo hace dividiendo el riesgo (proporción de incidencia, tasa de ataque) en el grupo 1 por el riesgo (proporción de incidencia, tasa de ataque) en el grupo 2. Los dos grupos generalmente se diferencian por factores demográficos como el sexo o por exposición a un factor de riesgo sospechoso, por ejemplo, consumo de alimento o contacto con casos sospechosos.
La fórmula para la razón de riesgo (RR) es:
Riesgo de enfermedad (proporción de incidencia, tasa de ataque) en el grupo de interés primarioRiesgo de enfermedad (proporción de incidencia, tasa de ataque) en el grupo de comparación
De ahí se puede tener que:
Si RR es igual a 1 indica un riesgo idéntico entre los dos grupos.
Si RR es mayor a 1 indica un mayor riesgo para el grupo del numerador, generalmente el grupo expuesto.
Si RR es menor a 1 indica una disminución del riesgo para el grupo expuesto, lo que indica que tal vez la exposición en realidad protege contra la aparición de enfermedades.
Ejemplo
- En un brote de un virus respiratorio entre estudiantes de una escuela, 28 de 157 estudiantes de primaria desarrollaron tuberculosis, en comparación con 4 de 137 estudiantes de secundaria. Definiendo la exposición cómo ser estudiante de la sede primaria, y la no exposición ser estudiante de la sede secundaria, se tiene que:
| Enfermos | Sanos | Total | |
|---|---|---|---|
| Estudiantes primaria | 30 | 120 | 150 |
| Estudiantes secondaria | 5 | 135 | 140 |
| Total | 35 | 265 | 290 |
Para calcular RR, primero se debe calcular la tasa de ataque para cada grupo.
Tasa de ataque para expuestos (Tuberculosis Sede primaria) = \(\frac{30}{150}=0,2=20\%\)
Tasa de ataque para no expuestos (Tuberculosis Sede secundaria) = \(\frac{51}{40}=0,036 = 3,6\%\)
Así, la RR es simplemente la razón de estos dos riesgos:
\(RR = \frac{20}{3,6}= 5,5\)
Por lo tanto, quienes eran estudiantes de la sede primaria tenían 5,5 veces la posibilidad de desarrollar tuberculosis comparado con los estudiantes de la sede secundaria.
- Odd Ratio (OR)
-
En los estudios de casos y controles, el Odds Ratio (OR) se utiliza para comparar las probabilidades de exposición a un factor de riesgo entre los casos (individuos con la enfermedad) y los controles (individuos sin la enfermedad). Esta medida ayuda a evaluar la asociación entre la exposición y la enfermedad.
Odds Odds de exposición entre casosOdds de exposición entre controles
Es importante tener en cuenta que el resultado no es una probabilidad.
Además, si este número es:
Igual a 1, significa que la frecuencia del evento es igual en expuestos y no expuestos, es decir no existe una asociación entre la exposición y el evento.
Mayor a 1, se tiene que la frecuencia del evento es mayor en expuesto que en no expuestos, lo que significa que la exposición es un factor de riesgo.
Menor a 1, significa que la frecuencia del evento es menor en expuestos que en no expuestos y en este caso se interpreta como que la exposición es un factor protector.
Ejemplo
Luego de una Conferencia Académica se notificó un brote de vómito y diarrea después del almuerzo. El almuerzo incluyó sándwiches. El total de asistentes fue de 100 personas; de las cuales 50 asistentes se enfermaron. Al realizar la investigación inicial, se encontró que en total 60 personas reportaron haber comido el sándwich del almuerzo. De estas 60, 35 se enfermaron y de las 40 que no comieron sándwich 15 reportaron síntomas de enfermedad. Resumiendo:
| Enfermos (Casos) | Sanos (Controles) | Total | |
|---|---|---|---|
| Expuestos (Consumió Sandwish) | 35 | 25 | 60 |
| No expuestos (No consumió Sandwish) | 15 | 25 | 40 |
| Total | 50 | 50 | 100 |
Calculando se tiene que;
Odds de la exposición en los casos: \(\frac{35}{15} = 2.3\)
Odds de la exposición en los controles: \(\frac{25}{25}=1\)
Razón de chances de la exposición (OR) \(= \frac{2.3}{1} = 2.3\)
Esto quiere decir que la posibilidad de presentar los síntomas reportados de enfermedad por la exposición al consumo del sandwich es 2.33 veces la posibilidad de desarrollar estos síntomas sin haber consumido el sándwich. Lo cual puede interpretarse como que el haber comido el sandwich significó un factor de riesgo.
Investigación de Brotes
- Curva epidémica
-
La curva epidémica es una representación gráfica que muestra la distribución de los casos de una enfermedad en función del tiempo durante un brote o epidemia. Es una herramienta fundamental en epidemiología para comprender la dinámica de una epidemia, identificar su origen, evaluar la efectividad de las intervenciones y predecir su evolución.
Características de la Curva Epidémica:
Eje X (Horizontal): Representa el tiempo (días, semanas, meses, etc.).
Eje Y (Vertical): Representa el número de casos nuevos de la enfermedad en cada unidad de tiempo.
Patrones: La forma de la curva puede variar dependiendo de cómo se transmite la enfermedad y de las características del brote.
Tipos de Curvas Epidémicas:
-
Curva de Punto (o de Fuente Común de Exposición):
Características: Tiene un pico agudo seguido de un descenso rápido. Suele ocurrir cuando todos los casos están expuestos a una fuente común de infección en un solo momento o en un periodo breve de tiempo.
Ejemplo: Un brote de intoxicación alimentaria en un evento social donde todos los casos están expuestos a un alimento contaminado al mismo tiempo.
-
Curva de Fuente Común Persistente:
Características: La curva muestra una meseta prolongada seguida de una caída, lo que indica una exposición continua o intermitente a una fuente común de infección.
Ejemplo: Un brote de cólera en una comunidad debido al suministro de agua contaminada que no se corrige de inmediato.
-
Curva de Transmisión Persona a Persona:
Características: Muestra múltiples picos sucesivos, que reflejan la transmisión de la enfermedad de una persona a otra. Cada pico representa una nueva generación de casos.
Ejemplo: Un brote de gripe estacional, donde el primer caso infecta a otros, quienes a su vez infectan a más personas, creando varios picos a lo largo del tiempo.
- Endemicidad
-
Implica niveles relativamente estables de transmisión que se reflejan en una incidencia más o menos constante de casos. No quiere decir que no se presenten cambios bruscos en la incidencia, con períodos de transmisión alta, debidos por ejemplo a fenómenos estacionales o cambios bruscos en el número de susceptibles (inmigrantes, por ejemplo). El límite entre endemicidad y endemicidad es muy difícil de establecer, con excepción de aquellas enfermedades importadas, en que el nivel endémico previo era cero. Las endemias pueden experimentar cambios temporales en su manifestación, los cuales se pueden describir como ciclos.
- Epidemicidad
-
Implica inestabilidad en la transmisión, niveles cambiantes que pueden ir desde cero hasta millones de casos.
- Brote
-
Es un término empleado comúnmente para describir la aparición brusca e inesperada de casos de una enfermedad.
- Ciclos estacionales
-
Se presentan ligados a las estaciones (invierno y virus respiratorios en países templados), o a los ciclos climáticos (temporada de lluvias y malaria en el trópico).
- Pandemia
-
Se refiere a epidemias de gran magnitud en cuanto a extensión geográfica, y prolongada duración, del tipo de la influenza, el cólera o el SIDA en nuestra época.
Conceptos Básicos
- Infección vs. enfermedad
-
La infección es el proceso en el cual un agente infeccioso entra, se desarrolla y se multiplica en el organismo de una persona o animal. Durante la infección, un individuo puede ser infeccioso, es decir, capaz de transmitir el agente a otros, incluso si no presenta síntomas.
La enfermedad, por otro lado, es el estado en el cual una infección resulta en el desarrollo de síntomas clínicos. Un individuo con enfermedad generalmente es infeccioso, pero puede haber periodos en los que sea infeccioso antes de mostrar síntomas.
Ejemplo: Una persona puede estar infectada con el virus del VIH y ser infecciosa sin mostrar síntomas durante años. Sin embargo, cuando desarrolla SIDA, presenta síntomas graves. Es crucial entender que se transmite el agente infeccioso (como el VIH), no los síntomas de la enfermedad (como el SIDA).
Esta distinción es muy importante en epidemiología de enfermedades infecciosas.
- Agente Patógeno
-
Un agente patógeno es un microorganismo que puede causar enfermedades en un organismo hospedero. Estos pueden subdividirse en vivos y no vivos. Los vivos incluyen bacterias, como el Mycobacterium tuberculosis que causa tuberculosis; parásitos, como el Plasmodium falciparum que causa malaria; y hongos, como el Candida albicans que causa candidiasis. Aunque los virus, como el SARS-CoV-2 que causa COVID-19, también son agentes patógenos, no se consideran vivos porque no pueden llevar a cabo procesos metabólicos por sí mismos y requieren una célula huésped para replicarse. Todos estos patógenos invaden, se replican y dañan los tejidos del huésped, provocando enfermedades. Su estudio es fundamental en epidemiología para desarrollar estrategias efectivas de prevención, control y tratamiento de enfermedades infecciosas.
- Caso
-
Un caso es una persona identificada como padeciente de una enfermedad o evento de interés epidemiológico, ya sea mediante diagnóstico clínico, pruebas de laboratorio o criterios epidemiológicos. Los casos se pueden clasificar de la siguiente manera:
Caso sospechoso: Individuo que presenta síntomas compatibles con una enfermedad pero aún no ha sido confirmado por pruebas de laboratorio.
Caso probable: Individuo que muestra signos y síntomas de una enfermedad y cumple con criterios epidemiológicos específicos, pero no tiene confirmación de laboratorio.
Caso confirmado: Individuo diagnosticado con una enfermedad mediante pruebas de laboratorio específicas.
Caso índice (caso primario): El primer caso detectado o notificado en un brote epidémico.
Caso secundario: Un caso que ocurre como resultado de la transmisión desde el caso índice o primario.
- Hospedero
-
Persona o animal vivo (mamífero, reptil, ave, etc), que en circunstancias naturales permite la subsistencia o el alojamiento de un agente infeccioso. No se consideran hospederos a los insectos artrópodos.
- Vector
-
Un vector puede definirse como un organismo vivo capaz de transmitir un agente infeccioso entre otros organismos vivos (OMS, 2020). Sin embargo, esta definición puede variar de acuerdo con los criterios que se empleen. Algunos de los criterios empleados incluyen el enfoque antropocéntrico (enfermedades transmitidas hacia humanos), el de microdepredador (que enfatiza la ingesta de fluidos del huésped mediante contacto directo), el de artrópodos hematófagos (artrópodos que se alimentan de sangre), el basado en morbilidad (transmisión de enfermedades al huésped), el basado en movilidad (vector con alta movilidad) y el de transmisión secuencial de la infección (transmisión mutua de la infección entre el vector y el huésped) (Wilson et al., 2017). Dependiendo de los puntos seleccionados, la definición puede variar y abarcar diversos seres vivos. Además, la transmisión puede tratarse de una función de simple acarreo mecánico (Transmisión Mecánica), o el agente infeccioso puede multiplicarse o desarrollarse dentro del vector (Transmisión Biológica).
Ejemplo: El mosquito Aedes aegypti es vector del virus del Dengue.
- Portador
-
Persona (o animal) que alberga un agente infeccioso específico sin presentar síntomas o signos clínicos de esta, y que constituye una fuente potencial de infección para el ser humano.
- Reservorio
-
Cualquier ser humano, animal, artrópodo, planta, suelo o materia inanimada, o combinación de estos, donde normalmente vive y se multiplica un agente infeccioso y del cual depende para su supervivencia, reproduciéndose de manera que pueda ser transmitido a un huésped susceptible.
- Mínimo tamaño poblacional (Minimum Community Size)
-
Se define como el tamaño mínimo de una población cerrada dentro del cual un patógeno no zoonótico de persona a persona puede persistir indefinidamente. En otras palabras, es el tamaño total de la población (de individuos susceptibles e infectados, u otros) necesario para sostener un brote una vez que ha aparecido.
- Superdispersión
-
Evento en el que una enfermedad infecciosa se propaga mucho más de lo habitual. Asimismo, un individuo que infecta de manera desproporcionada a un gran número de individuos y probablemente impulsa la velocidad y la gravedad de un brote se conoce como superpropagador.
- Transmisión vectorial
-
La transmisión vectorial significa que una infección puede ser transmitida de un vector (por ejemplo, mosquitos) a los humanos. Ejemplos de enfermedades transmitidas por vectores incluyen la malaria y el dengue. La Organización Mundial de la Salud tiene una hoja informativa sobre las enfermedades transmitidas por vectores con información clave y una lista de ellas según su vector.
- Excreción viral (Viral Shedding)
-
La excreción viral es el proceso mediante el cual un virus se libera del organismo infectado al medio ambiente, donde puede potencialmente infectar a otros individuos. Este fenómeno es fundamental en la transmisión de enfermedades virales, ya que determina cuándo y cómo una persona infectada puede ser contagiosa.
- Patogenicidad
-
La patogenicidad es la capacidad de un agente infeccioso, como un virus, bacteria, hongo o parásito, para causar enfermedad en un huésped. Esta capacidad depende de varios factores inherentes al agente infeccioso y su interacción con el huésped. La patogenicidad se evalúa en términos cualitativos, es decir, si un microorganismo es capaz de causar enfermedad o no.
Características de la Patogenicidad:
Capacidad para Causar Enfermedad: No todos los microorganismos son patógenos; la patogenicidad indica si un organismo puede causar enfermedad en condiciones normales.
Mecanismos de Patogenicidad: Incluye varios procesos biológicos que permiten al agente infeccioso invadir y dañar al huésped, como la adhesión a células huésped, la invasión de tejidos, la evasión del sistema inmunitario y la producción de toxinas.
- Virulencia
-
La virulencia es una medida cuantitativa de la gravedad de la enfermedad causada por un agente infeccioso. Representa la intensidad de la patogenicidad de un microorganismo, es decir, su capacidad no solo para infectar, sino también para causar daño significativo al huésped. A menudo, la virulencia se evalúa en términos de la tasa de mortalidad, la gravedad de los síntomas y el impacto en la salud del huésped.
Características de la Virulencia:
Gravedad de la Enfermedad: Cuantifica el daño que un patógeno puede causar en el huésped, incluyendo la severidad de los síntomas y la tasa de mortalidad.
Factores de Virulencia: Moléculas y mecanismos que permiten al patógeno invadir al huésped, evadir su sistema inmunitario, y causar daño. Estos incluyen toxinas, enzimas, proteínas de adhesión y mecanismos de evasión inmunitaria.
- Resistencia natural
-
La resistencia natural a un patógeno se refiere a la capacidad inherente de un organismo para evitar la infección o combatir un agente infeccioso sin la necesidad de una exposición previa, vacunación o tratamiento. Esta resistencia puede ser el resultado de varias características biológicas y genéticas del huésped que impiden la entrada, replicación o propagación del patógeno.
Características de la Resistencia Natural:
Inherente: Es una característica innata del organismo, presente sin necesidad de una exposición previa al patógeno.
Genética: A menudo, la resistencia natural está determinada por factores genéticos que pueden variar entre individuos y poblaciones.
Específica del Patógeno: La resistencia natural puede ser específica para ciertos patógenos mientras que otros pueden no verse afectados.
Ejemplo: En estudios realizados en África Subsahariana, se ha observado que las poblaciones con un alto porcentaje de individuos Duffy-negativos presentan una muy baja incidencia de infecciones por Plasmodium vivax. En contraste, en regiones de Asia y América del Sur, donde la mayoría de las personas son Duffy-positivas, la malaria por Plasmodium vivax es más común.
- Infestación
-
Es un término empleado para un hospedero afectado por ectoparásitos, pulgas por ejemplo. También para referirse a la infestación por insectos o reservorios en casas o lugares (la casa está infestada de tratominos, la ciudad está infestada por ratas, la tasa de infestación es del 10%).
- Infección patente
-
Es el período durante el cual el agente infeccioso todavía no ha producido ningún signo ni síntoma, pero ya es detectable por algún medio en el hospedero.
- Infección latente o subclínica
-
El agente infeccioso está presente en el hospedero, pero no hay indicios de su presencia. Este estado es muy difícil de diferenciar de la incubación en el hospedero.
- Enfermo
-
El hospedero presenta signos o síntomas patológicos.
- Portador
-
Es un estado infectivo prolongado, con eliminación persistente del agente infeccioso. Puede ser portador enfermo, portador convaleciente o portador sano.
- Inmune
-
Posee protección activa o pasiva, celular y/o humoralmente mediada contra la infección.
- Inmunidad Activa
-
Inmunidad debida a una exposición previa a antígenos del agente o similares a él.
- Inmunidad Pasiva
-
Inmunidad debida a la transferencia de anticuerpos, maternos o de otro origen.
- Rango de hospederos
-
Aquellas especies de organismos que son naturalmente susceptibles a cierto agente infeccioso.
- Reservorio
-
Especies o poblaciones que son capaces de mantener en la naturaleza un determinado agente infeccioso.
- Hospedero definitivo
-
Aquel en el cual se realiza la reproducción sexual del agente, cuando este tiene una fase sexual obligatoria en su ciclo de vida. Esto sucede en muchos helmintos y protozoarios.
- Hospedero intermediario
-
Cuando el ciclo vital involucra dos especies diferentes de hospederos, este término describe al hospedero en el cual se realiza la fase asexual de la reproducción.
- Hospedero amplificador
-
Una especie de hospedero que desarrolla epidemias periódicas por un determinado agente, y que genera un aumento en el tamaño de la población de agentes lo suficientemente grande, como para propagarse a otras especies usualmente no expuestas a ese agente.
- Hospedero final
-
Aquella especie o especies, cuyos individuos son infectados pero no son funcionalmente infectivos, y por consiguiente no transmiten la infección.
- Duración de la infectividad
-
Guarda relación directa con el tiempo durante el cual el hospedero infectado excreta cantidades considerables del agente infeccioso.
- Recaída o recrudescencia
-
Implica la recurrencia de los signos clínicos después de un período de enfermedad inaparente o subclínica.
- Transmisión vertical
-
Implica la transferencia directa de un agente infeccioso desde un progenitor hacia la prole, bien sea por la vía transplacentaria o transovárica.
- Transmisión horizontal
-
Se refiere a la transferencia directa del patógeno desde alguien diferente a los progenitores.
REFERENCIAS
Alzate, A. (1996). Conceptos básicos de enfermedades infecciosas. Boletín SIEI, 2(2), 2-5
Cambridge English Dictionary. (n.d.). Shedding. En Cambridge English Dictionary. Recuperado de https://dictionary.cambridge.org
Epiverse-Trace. (n.d.). Glossary. Recuperado de https://epiverse-trace.github.io/tutorials-late/reference.html#glossary
Glosario epidemiológico. Gobierno de Mexico. https://www.insp.mx/nuevo-coronavirus-2019/glosario-epidemiologico.html
Holmdahl, I., & Buckee, C. (2020). COVID-19 epidemic prediction and the impact of public health interventions: A review of COVID-19 epidemic models. ScienceDirect. Recuperado de https://www.sciencedirect.com
Keeling, M. J., & Rohani, P. (2008). A primer on stochastic epidemic models: Formulation, numerical simulation, and analysis. ScienceDirect. Recuperado de https://www.sciencedirect.com
Kucharski, A. J., & Edmunds, W. J. (2018). Key data for outbreak evaluation: Building on the Ebola experience. Philosophical Transactions of the Royal Society B: Biological Sciences. Recuperado de https://royalsocietypublishing.org
Lloyd-Smith, J. O., Schreiber, S. J., Kopp, P. E., & Getz, W. M. (2005). Superspreading and the effect of individual variation on disease emergence. Nature. Recuperado de https://www.nature.com
Math Insight. (n.d.). An introduction to ordinary differential equations. Recuperado de https://mathinsight.org
Milwid, R. (2016, 28 septiembre). Toward Standardizing a Lexicon of Infectious Disease Modeling Terms. Frontiers. https://www.frontiersin.org/articles/10.3389/fpubh.2016.00213/full
Nishiura, H., Linton, N. M., & Akhmetzhanov, A. R. (2020). Serial interval of novel coronavirus (COVID-19) infections. International Journal of Infectious Diseases. Recuperado de https://www.ijidonline.com
Organización Panamericana de la Salud. COVID-19, GLOSARIO SOBRE BROTES Y EPIDEMIAS. PAHO. https://www.paho.org/es/documentos/covid-19-glosario-sobre-brotes-epidemias-recurso-para-periodistas-comunicadores
Organización Panamericana de la Salud. Módulo de Principios de Epidemiología para el Control de Enfermedades (MOPECE) Segunda Edición Revisada. Unidad 5. Investigación epidemiológica de campo: aplicación al estudio de brotes. https://www3.paho.org/hq/index.php?option=com_content&view=article&id=9161:2013-mopece-training-modules-epidemiology&Itemid=0&lang=es#gsc.tab=0
Park, S. (n.d.). Epidist-paper. GitHub. Recuperado de https://github.com
Wellcome Open Research. (n.d.). Estimating the overdispersion in COVID-19. Recuperado de https://wellcomeopenresearch.org
World Health Organization. (n.d.). Vector-borne diseases. Recuperado de https://www.who.int
