Accéder aux distribution des délais épidémiologiques
Figure 1
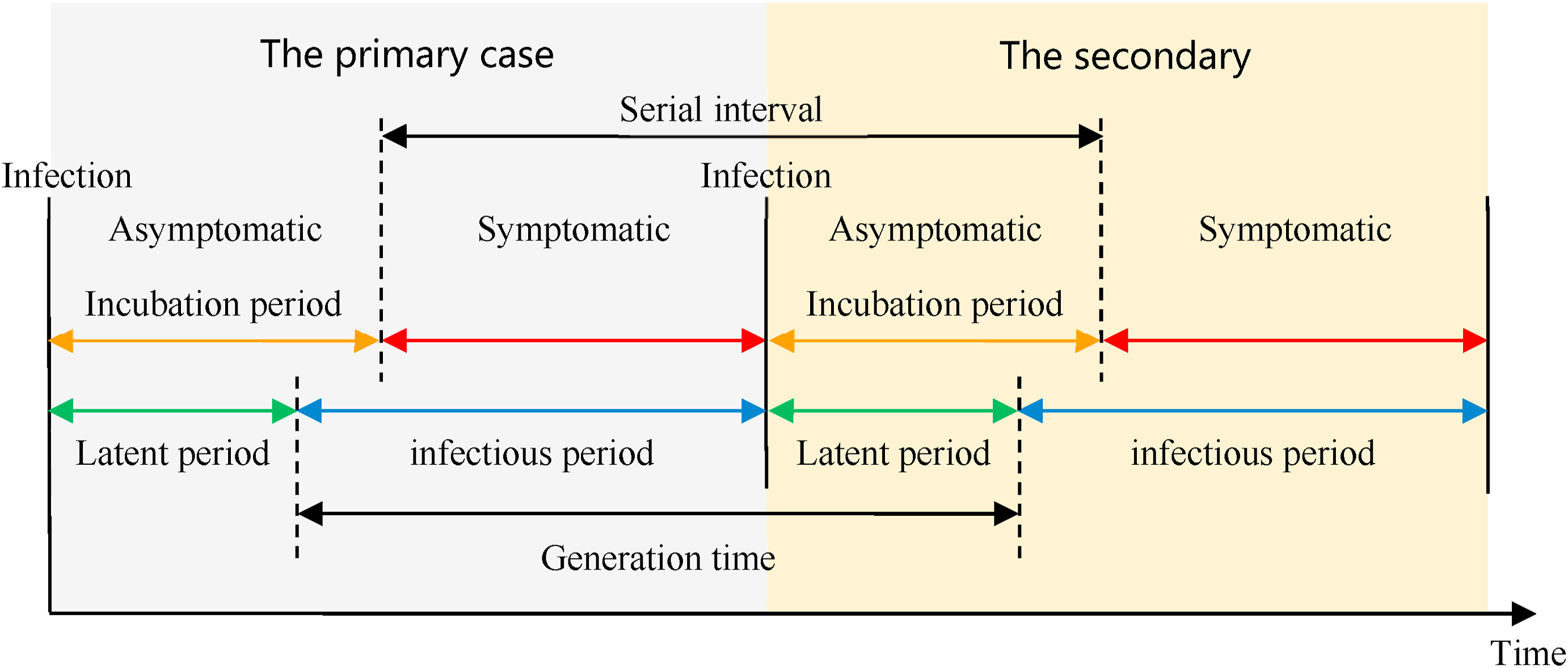
Définition des périodes clés. A partir de Xiang
et al, 2021
Figure 2
Vidéo du MRC Centre for Global Infectious
Disease Analysis, Ep 76. Science In Context - Epi Parameter Review Group
avec le Dr Anne Cori (27-07-2023) at https://youtu.be/VvpYHhFDIjI?si=XiUyjmSV1gKNdrrL
Figure 3
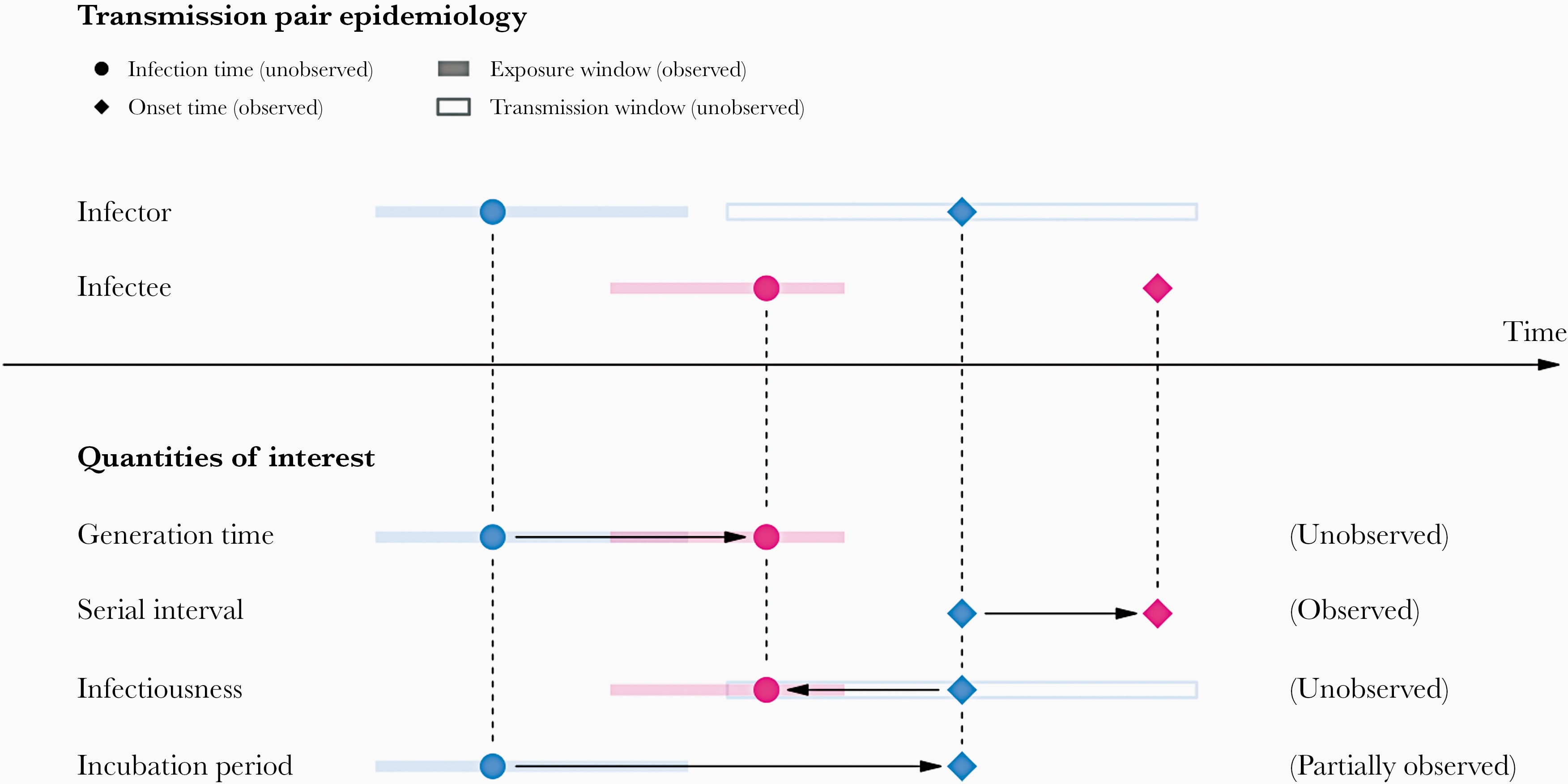
Schéma de la relation entre les différentes
périodes de transmission entre un infecteur et un infecté dans une paire
de transmission. La fenêtre d’exposition est définie comme l’intervalle
de temps entre l’exposition au virus et la fenêtre de transmission est
définie comme l’intervalle de temps pour la transmission ultérieure par
rapport à la durée de l’infection (Chung
Lau et al., 2021).
Figure 4
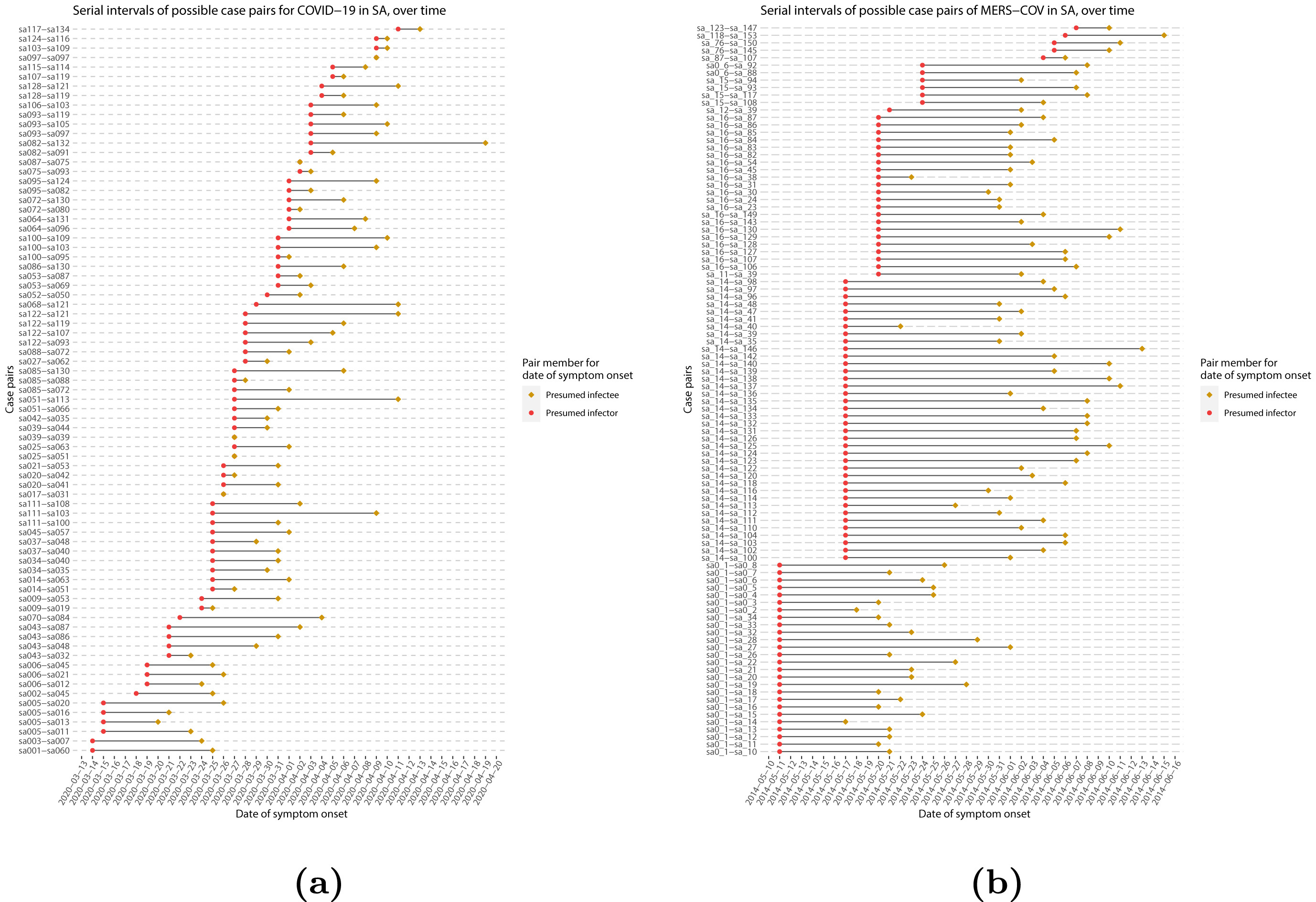
Intervalles sériels des paires de cas possibles
dans (a) COVID-19 et (b) MERS-CoV. Les paires représentent un infecteur
présumé et son contaminé présumé en fonction de la date d’apparition des
symptômes (Althobaity
et al., 2022).
Figure 5
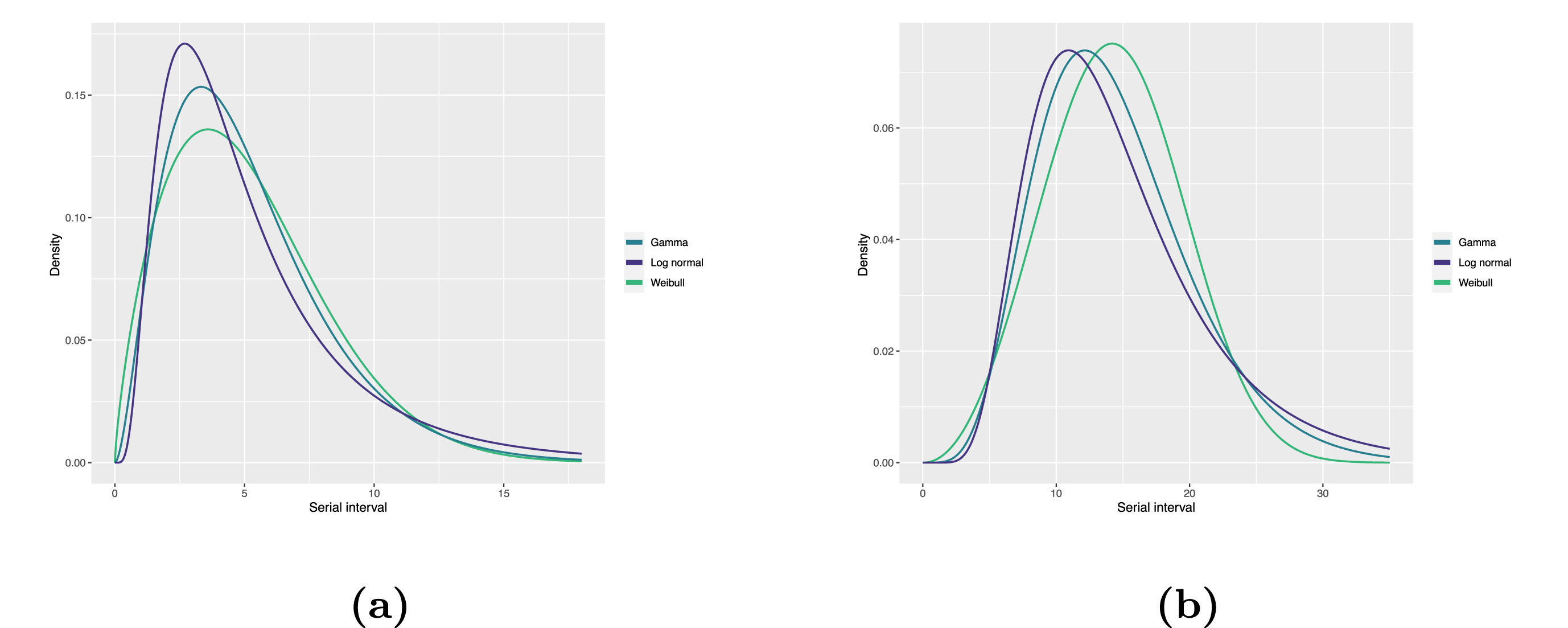
Distribution d’intervalles sériels ajustée pour
(a) COVID-19 et (b) MERS-CoV sur la base des paires de transmission
signalées en Arabie saoudite. Nous avons ajusté trois distributions
couramment utilisées, les distributions Log normal, Gamma et Weibull,
respectivement (Althobaity
et al., 2022).
Figure 6
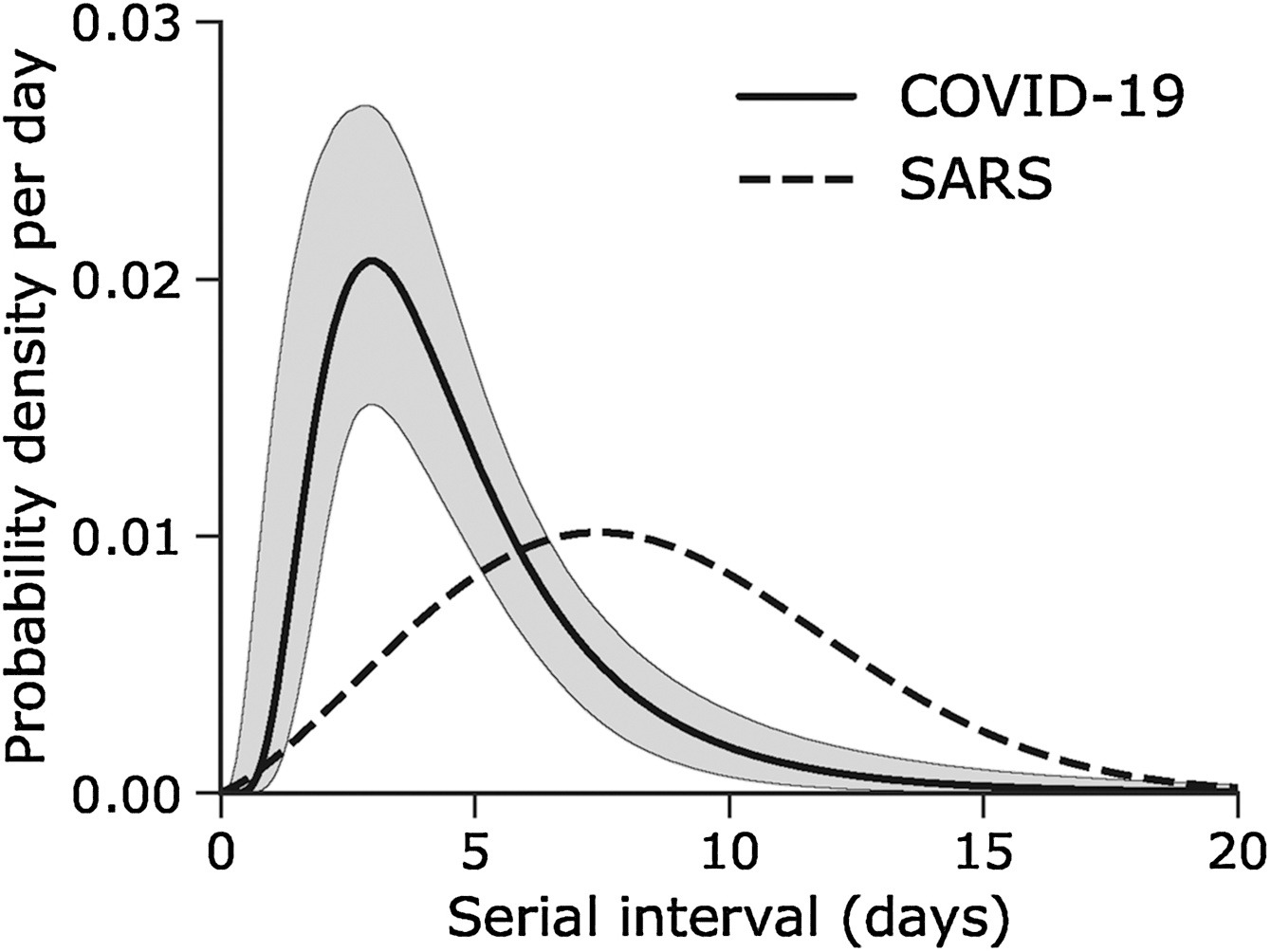
Intervalle en série des infections par le
nouveau coronavirus (COVID-19) superposé à une distribution publiée du
SRAS. (Nishiura
et al., 2020)
Figure 7
Quantifier la transmission
Figure 1
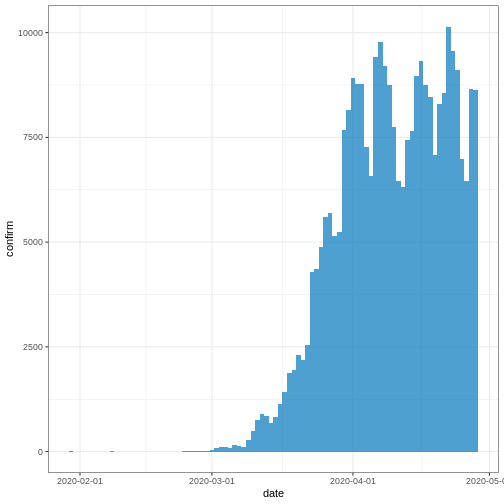
Figure 2
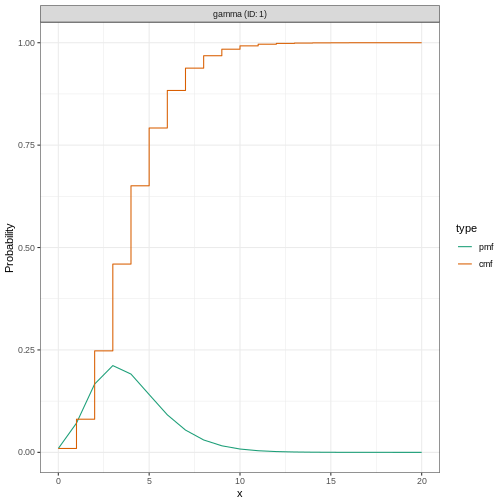
Figure 3
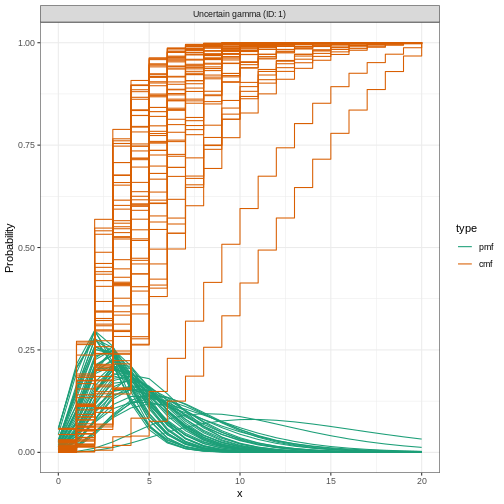
Figure 4
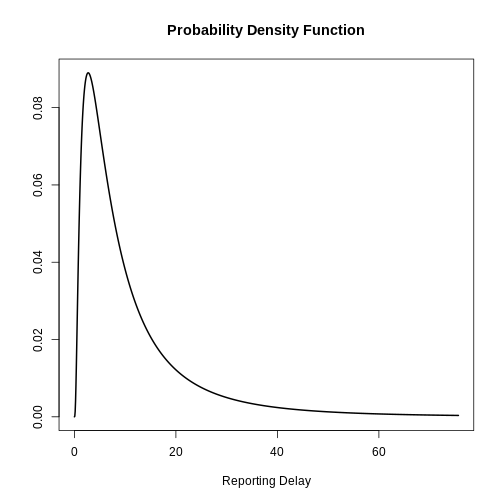
Figure 5
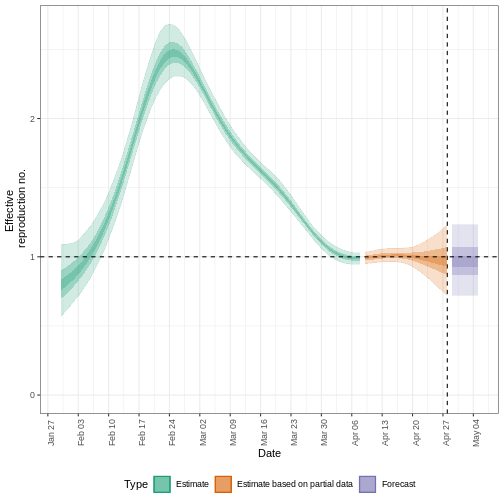
Figure 6
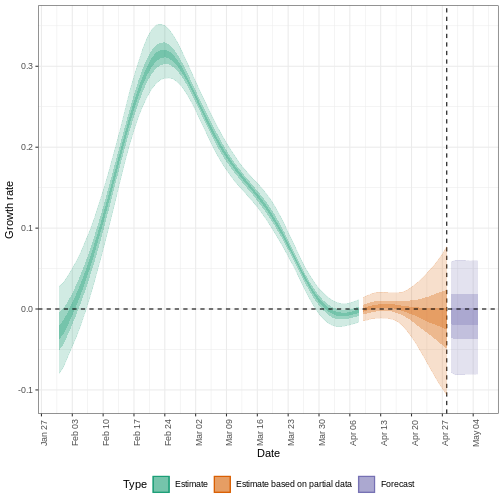
Figure 7
Utiliser les distributions de délais dans l'analyse
Figure 1
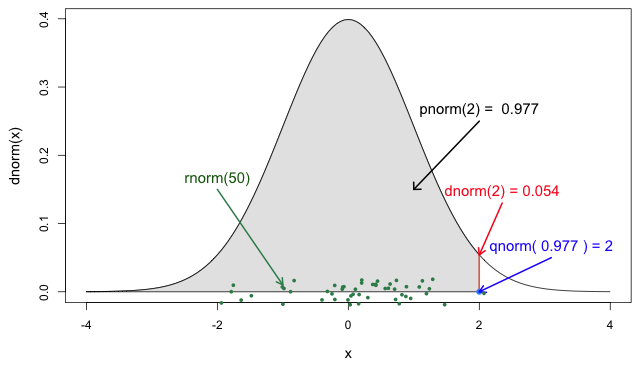
Les quatre fonctions de probabilité de la loi
normale (Jack
Weiss, 2012)
Figure 2
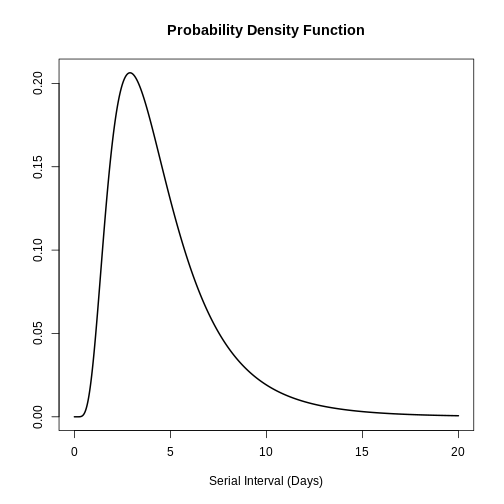
Figure 3
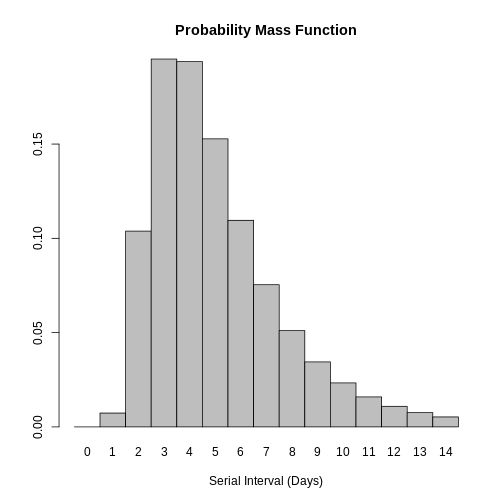
Figure 4
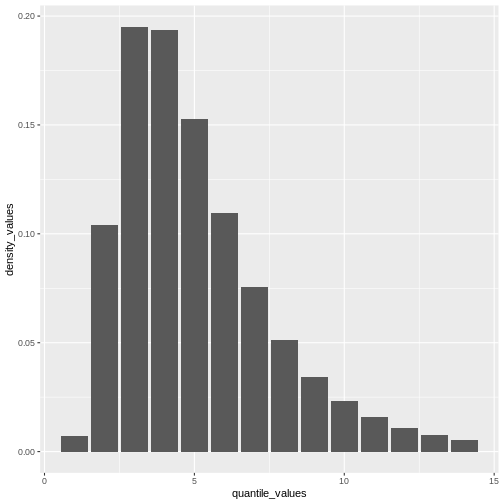
Figure 5
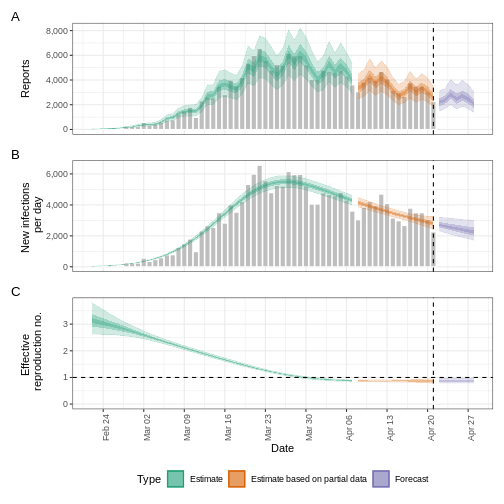
Figure 6
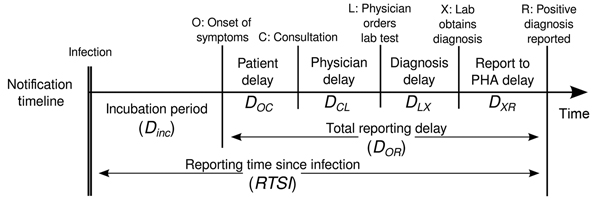
Calendrier pour la déclaration de la
chaîne de la maladie, Pays-Bas. Lab, laboratoire ; PHA,
autorité de santé publique. A partir de Marinović
et al, 2015
Figure 7
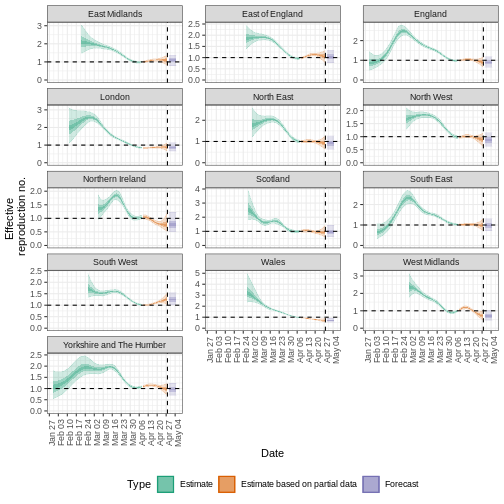
\(R_{t}\) est une mesure de la transmission
au moment \(t\). Les
observations après le temps \(t\)
doivent être ajustées. ICU, unité de soins intensifs. A partir de Gostic
et al, 2020
Figure 8
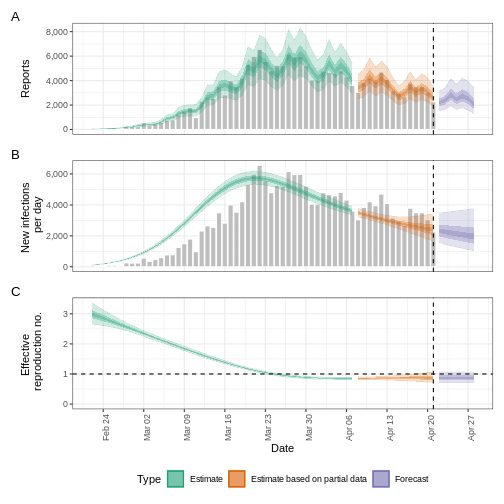
Figure 9
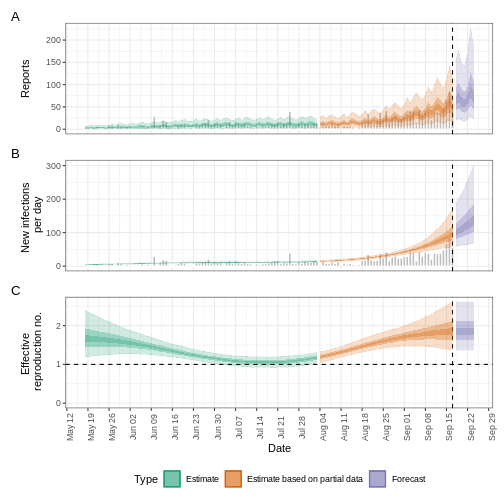
Figure 10
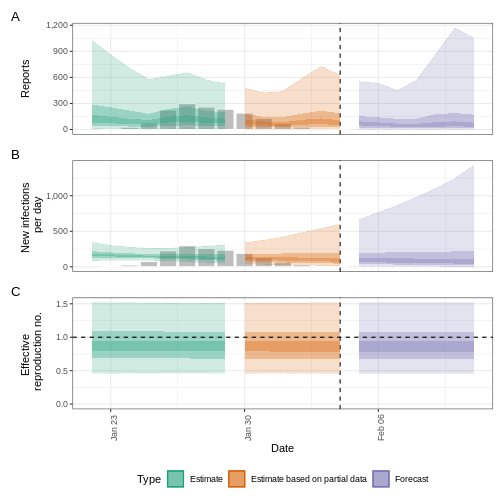
Établir des prévisions à court terme
Figure 1
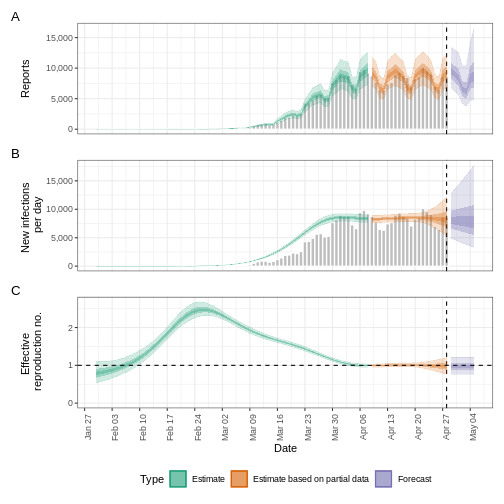
Figure 2
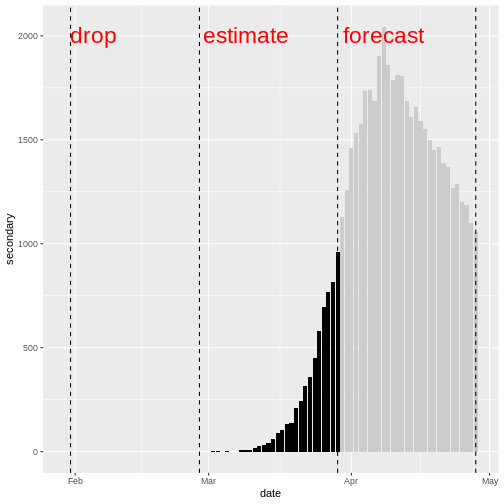
Figure 3
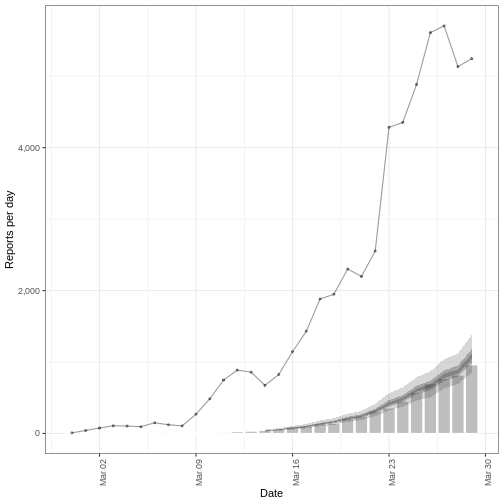
Figure 4
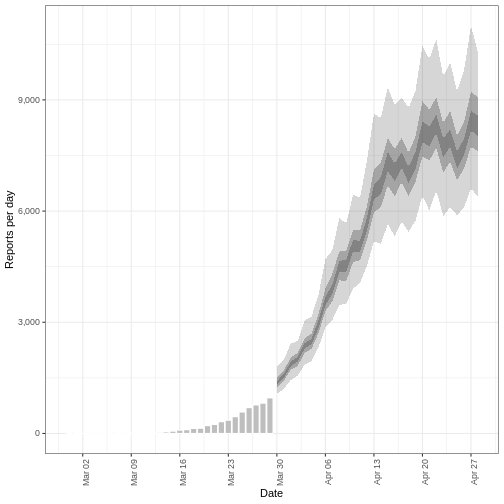
Estimation de la gravité d'une épidémie
Figure 1
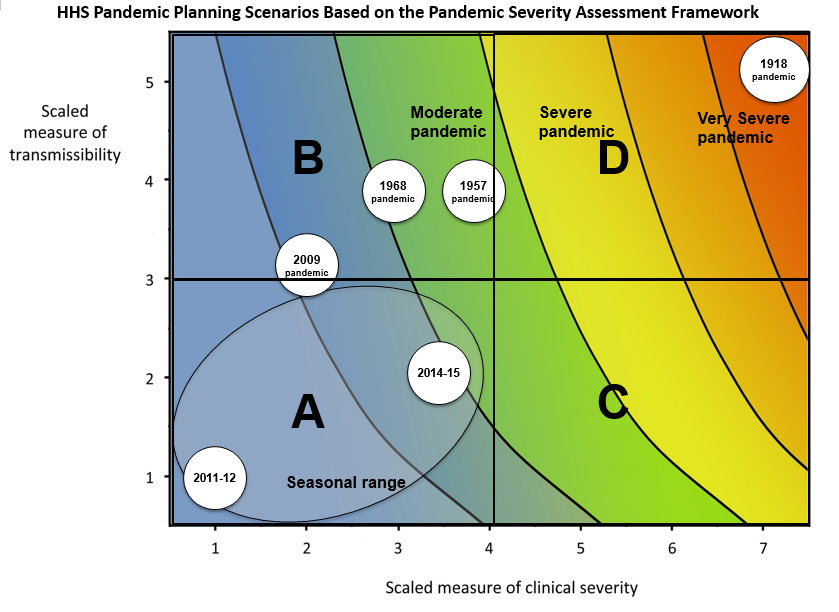
Scénarios de planification pandémique du HHS
basés sur le cadre d’évaluation de la gravité de la pandémie. Ce cadre
utilise une mesure combinant la gravité clinique et la transmissibilité
pour caractériser les scénarios de pandémie de grippe.
HHS: United States Department of Health and Human
Services (CDC,
2016)
Figure 2
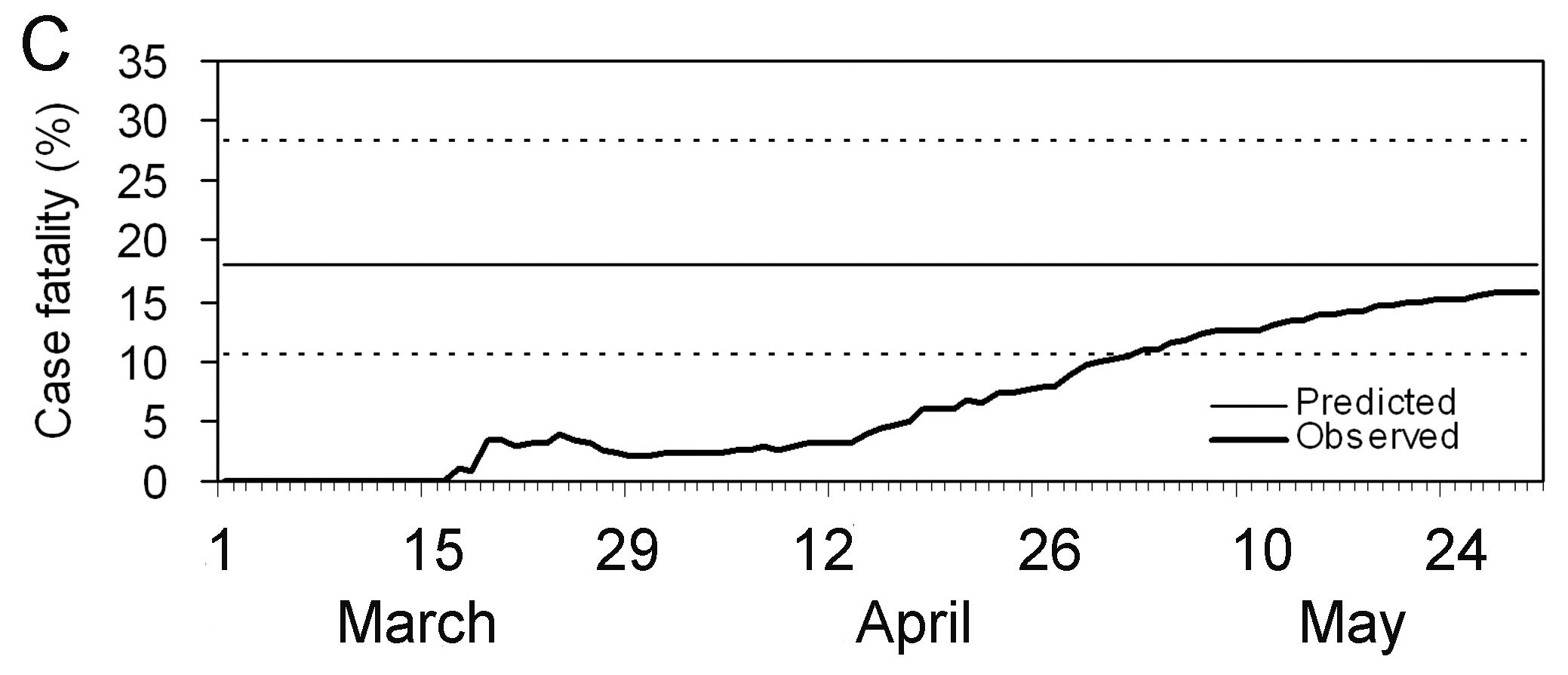
Estimations du risque de létalité (RL) observé
biaisé confirmé en fonction du temps (ligne épaisse), calculé comme le
rapport entre le nombre cumulé de décès et de cas confirmés à un instant
\(t\). La valeur atteinte à la fin
d’une épidémie (~30 mai) est le risque de létalité observé à la fin de
l’épidémie. La ligne horizontale continue et les lignes pointillées
indiquent la valeur du RL prédit et leurs intervalles de confiance à 95%
(IC \(95%\)) des valeurs prédites du
taux de mortalité ajusté au délai en utilisant uniquement les données
observées jusqu’au 27 mars 2003. (Nishiura
et al., 2009)
Figure 3
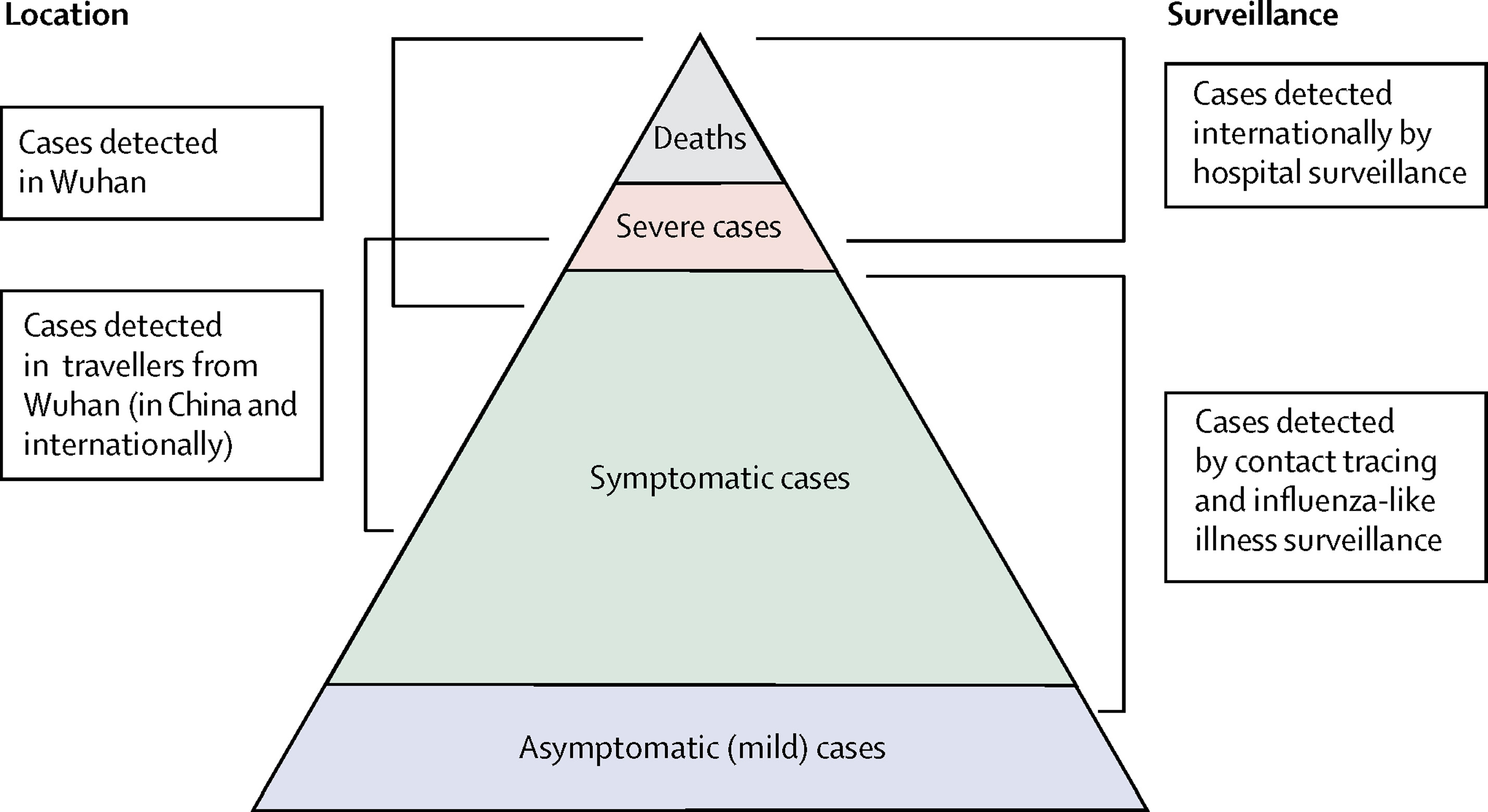
Spectre des cas de COVID-19. Le CFR vise à
estimer la proportion de décès parmi les cas confirmés d’une épidémie.
(Verity
et al., 2020)
Figure 4
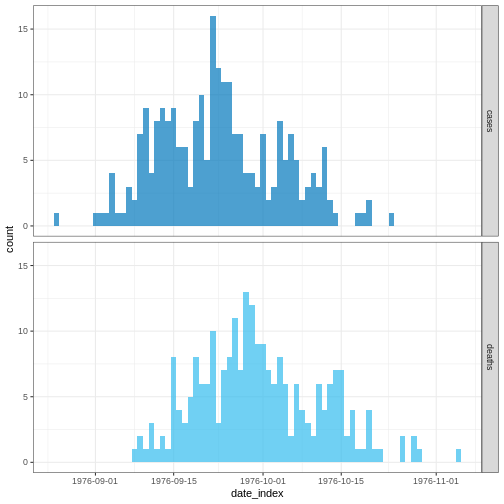
Figure 5
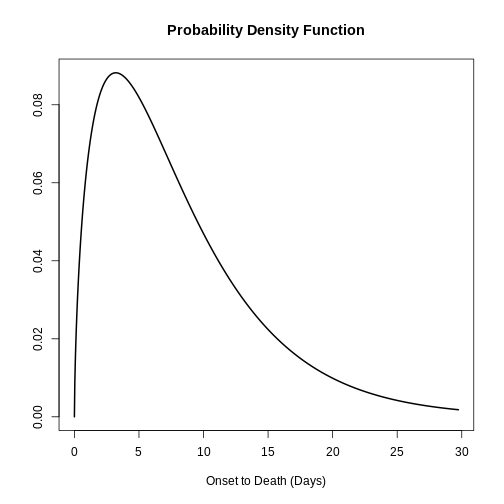
Figure 6
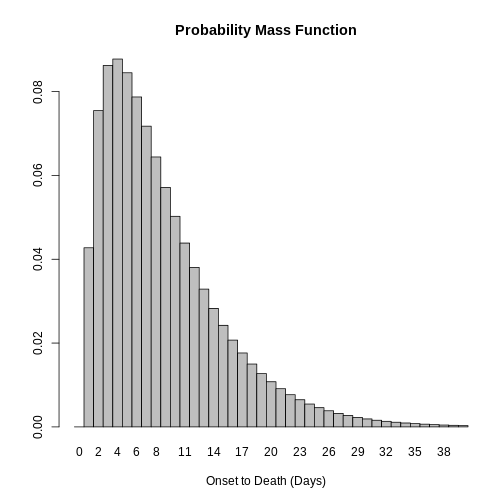
Figure 7
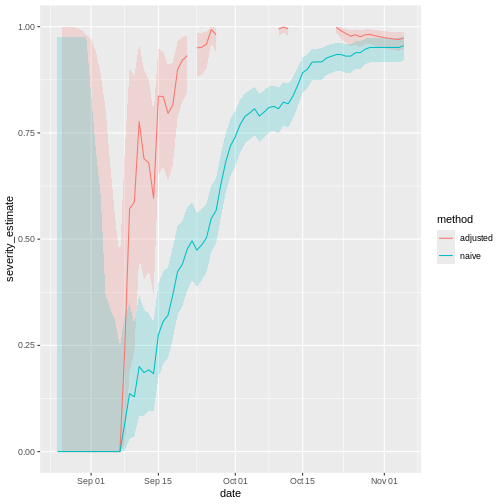
Figure 8
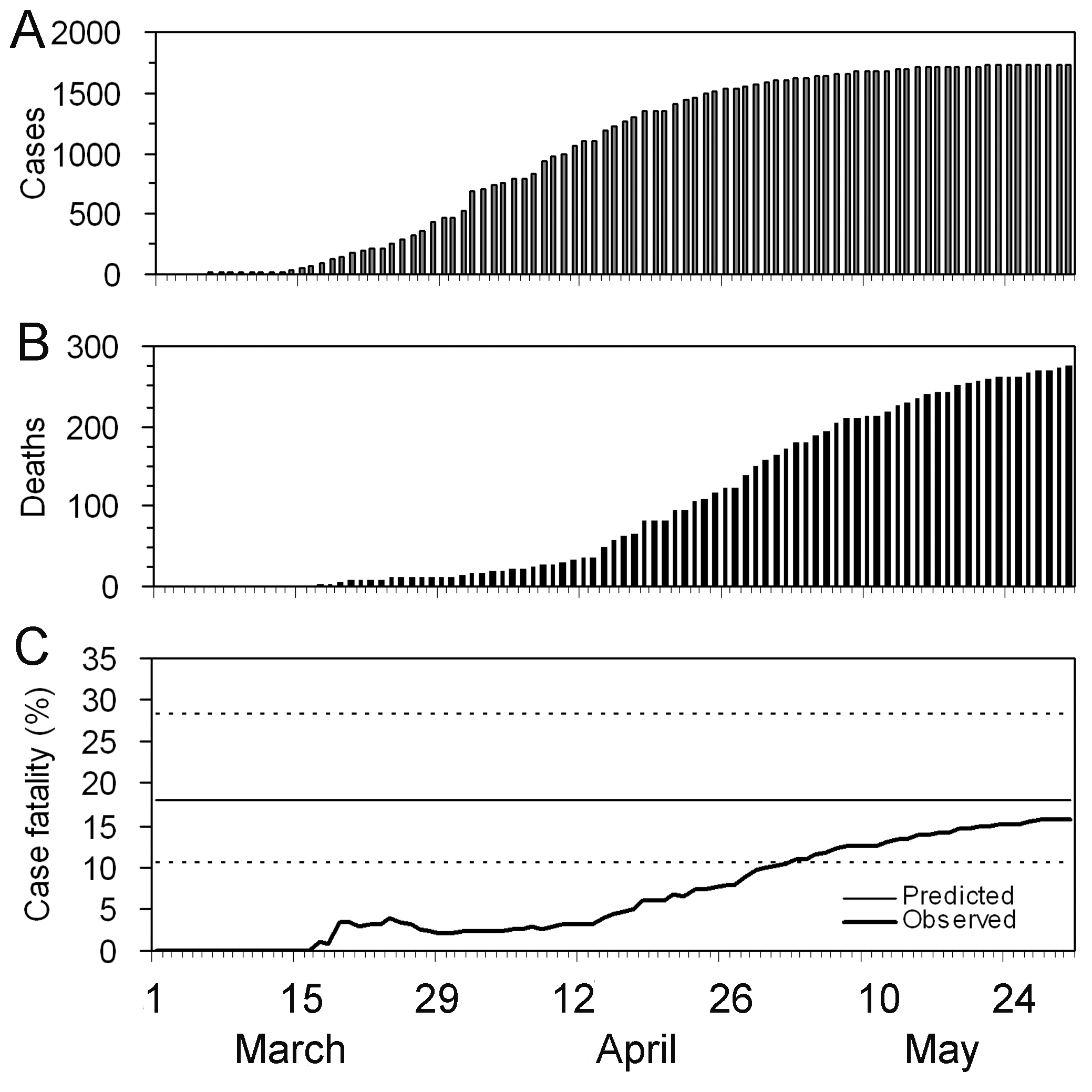
Risque observé (biaisé) de létalité des cas
confirmés du syndrome respiratoire aigu sévère (SARS) à Hong Kong, 2003.
(Nishiura
et al, 2009)
Figure 9
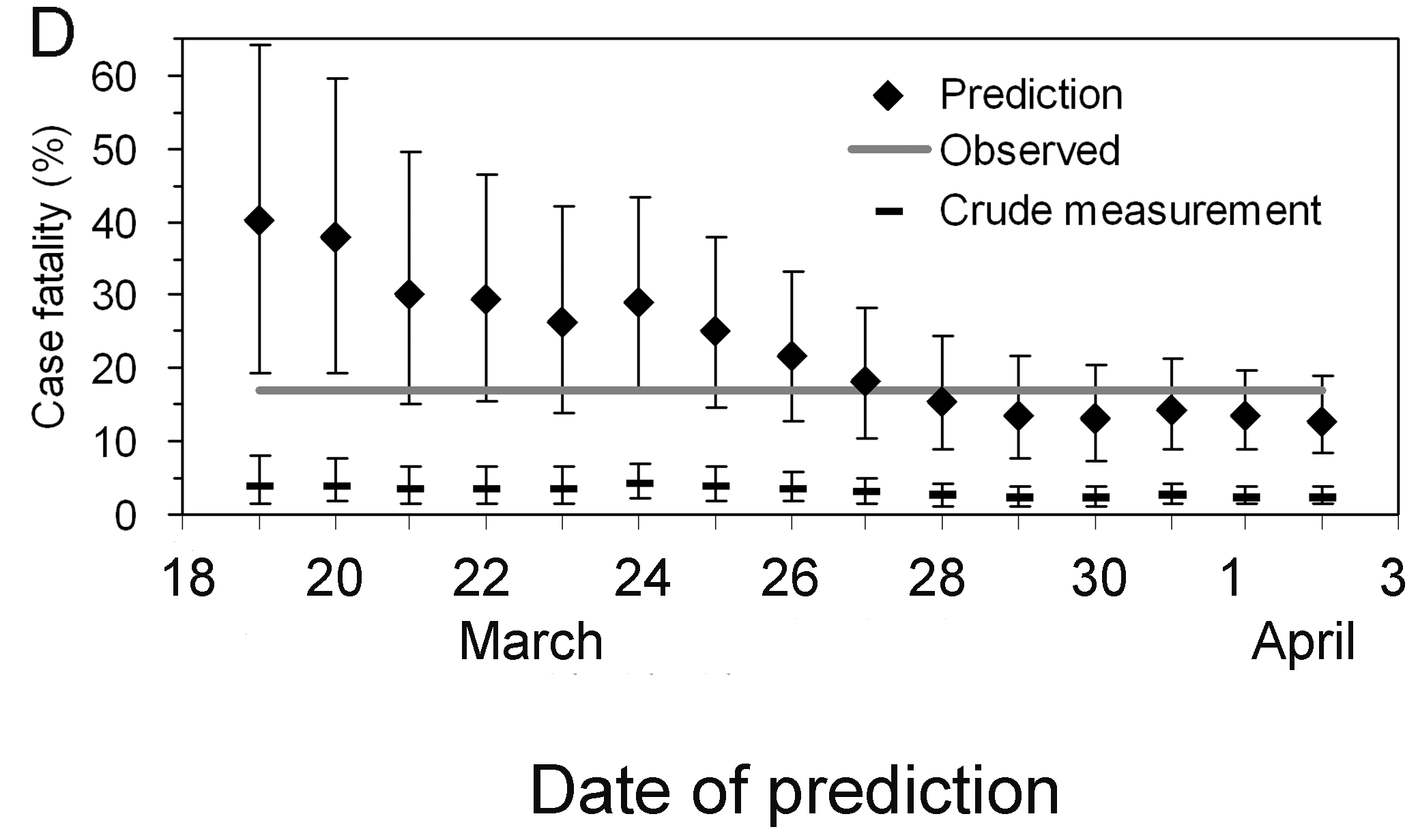
Détermination précoce du risque de létalité
confirmé, ajusté au délai, du syndrome respiratoire aigu sévère (SARS) à
Hong Kong, 2003. (Nishiura
et al, 2009)
Figure 10

La population des cas confirmés et le processus
d’échantillonnage pour l’estimation du RL non biaisé au cours d’une
épidémie selon Nishiura et
al. 2009
Figure 11
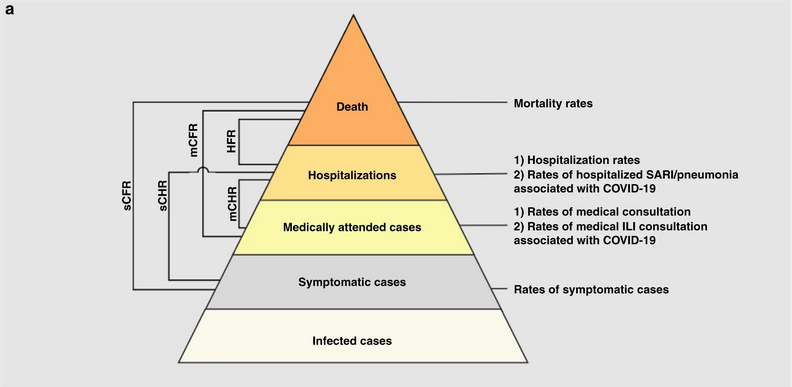
Niveaux de gravité des infections par le
SARS-CoV-2 et les paramètres d’intérêt. Chaque niveau est supposé être
un sous-ensemble du niveau inférieur.
Figure 12
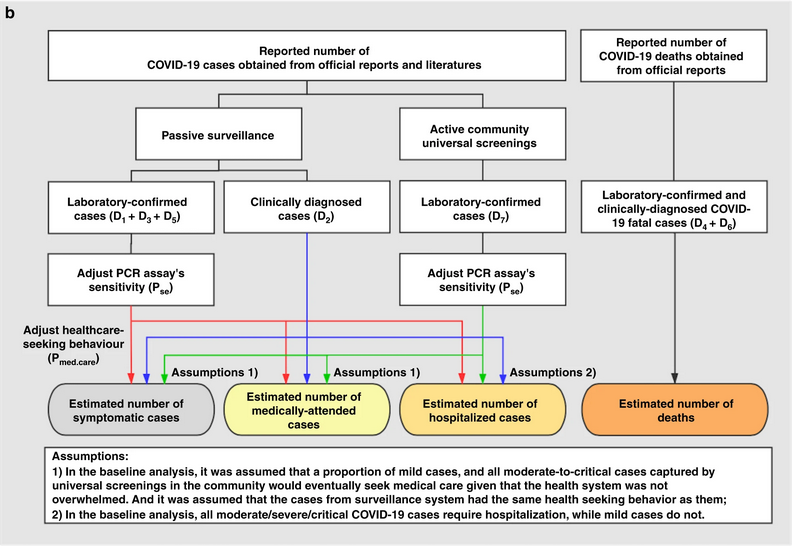
Schéma des analyses de base. Les flèches rouges,
bleues et vertes indiquent le flux de données provenant des cas
confirmés en laboratoire dans le cadre de la surveillance passive, des
cas diagnostiqués cliniquement et des cas confirmés en laboratoire dans
le cadre des dépistages actifs.
Tenir compte du phénomène hypercontagieux
Figure 1
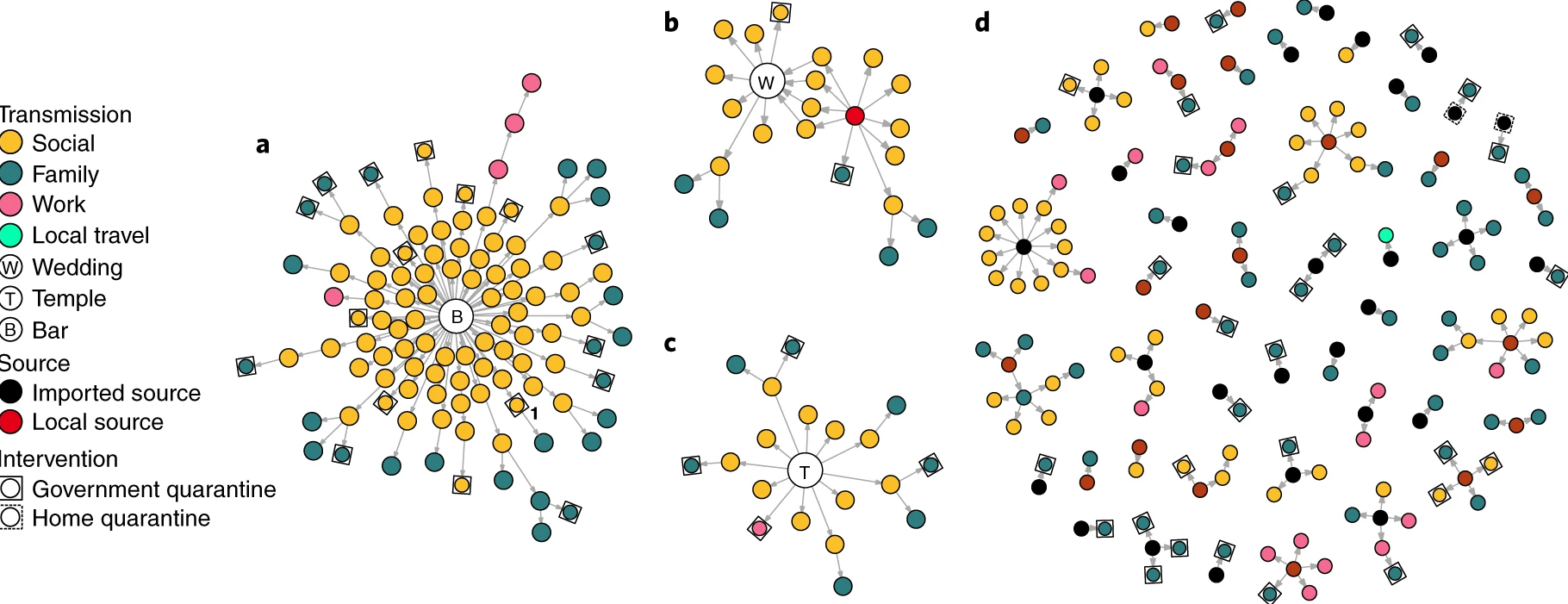
Chaînes de transmission du SRAS-CoV-2 à
Hong Kong initiées par des cas locaux ou importés.
(a), réseau de transmission d’un groupe de cas
remontant à un ensemble de quatre bars de Hong Kong (n = 106).
(b), réseau de transmission associé à un mariage sans
paires infectrices-infectieuses claires, mais lié à une réunion sociale
précédente et à une source locale (n = 22). (c), réseau
de transmission associé à un groupe de temples de source indéterminée (n
= 19). (d), tous les autres groupes d’infections par le
SRAS-CoV-2 dont la source et la chaîne de transmission ont pu être
déterminées (Adam et al.,
2020).
Figure 2
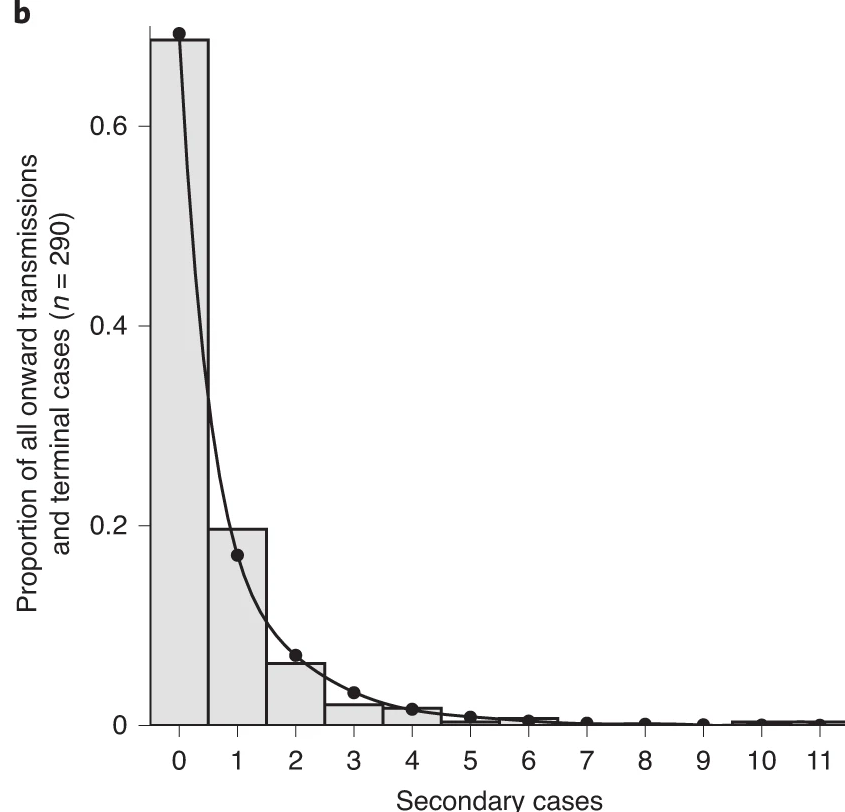
Distribution du nombre de cas
secondaires de SRAS-CoV-2 observée à Hong Kong. N = 91 infectés
par le SRAS-CoV-2, N = 153 infectés en phase terminale et N = 46 cas
locaux sporadiques. Les barres de l’histogramme indiquent la proportion
du nombre de cas secondaire generés. La ligne correspond à une
distribution binomiale négative ajustée (Adam et al.,
2020).
Figure 3

Figure 4
Figure 5
Figure 6
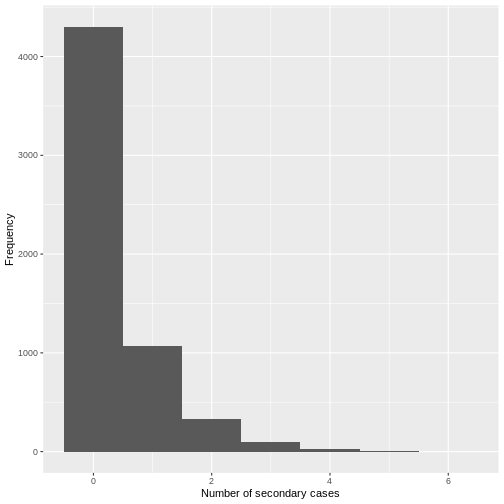
Figure 7
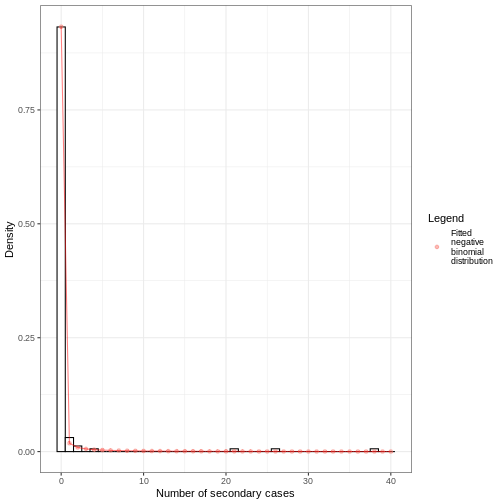
Figure 8
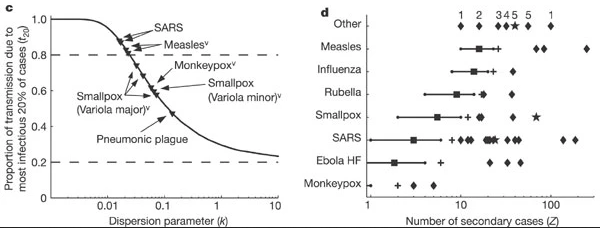
Preuve de la variation du nombre
d’individus reproducteurs(Gauche, c) Proportion de transmission
attendue à partir des 20 % de cas les plus infectieux, pour 10 ensembles
de données d’épidémies ou de surveillance (triangles). Les lignes en
pointillé indiquent les proportions attendues selon la règle des 20/80
(en haut) et l’homogénéité (en bas). (Droite, d), Événements de super
propagation signalés (SSE ; losanges) par rapport au nombre reproductif
estimé R (carrés) pour douze infections directement transmissibles. Les
croix indiquent le 99e centile proposé comme seuil pour les ESS. (Pour
plus de détails sur les figures, voir Lloyd-Smith et
al. 2005)
Figure 9
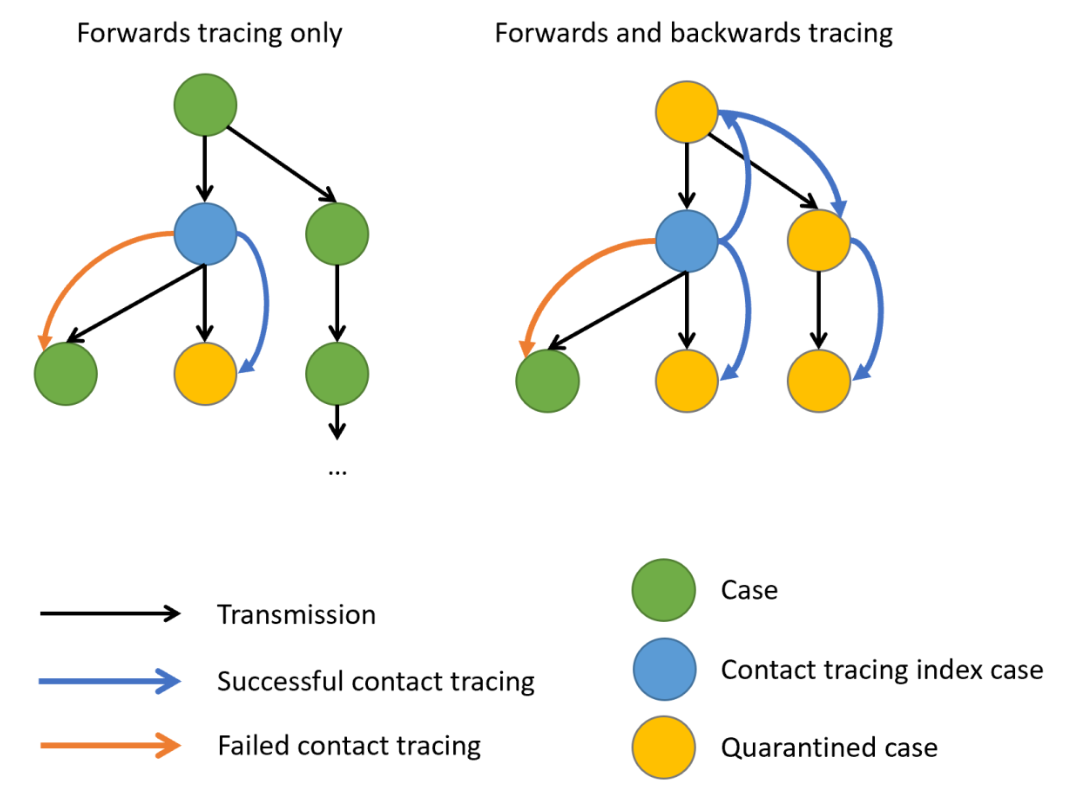
Représentation schématique des stratégies de
recherche de contacts. Les flèches noires indiquent le sens de la
transmission, les flèches bleues et orange indiquent respectivement une
recherche de contact réussie ou échouée. Lorsqu’il existe des preuves
d’une variation de la transmission au niveau individuel, entraînant
souvent une superspreading, la recherche de contacts en amont du cas
index (cercle bleu) augmente la probabilité de trouver le cas primaire
(cercle vert) ou des grappes avec une plus grande fraction de cas,
augmentant potentiellement le nombre de cas en quarantaine (cercles
jaunes). Claire
Blackmore, 2021
Figure 10
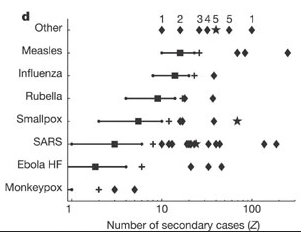
Événements de surmultiplication signalés
(diamants) par rapport au nombre de reproduction estimé R (carrés) pour
douze infections directement transmissibles. Les lignes indiquent les
percentiles 5-95 du nombre de cas secondaires suivant une distribution
de Poisson avec lambda égal au nombre de reproduction (\(Z∼Poisson(R)\)), et les croix indiquent le
99e centile proposé comme seuil pour les ESS. Les étoiles représentent
les ESS causés par plus d’un cas source. Les “autres” maladies sont les
suivantes 1, streptocoque du groupe A ; 2, fièvre de Lassa ; 3,
pneumonie à mycoplasme ; 4, peste pulmonaire ; 5, tuberculose. R n’est
pas indiqué pour les “autres” maladies et est hors échelle pour la
variole.
Simuler des chaînes de transmission
Figure 1
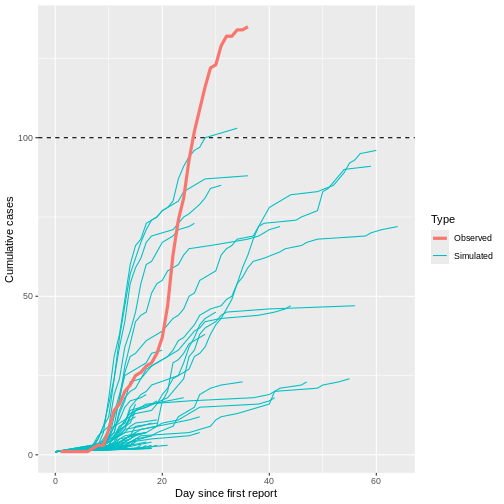
Figure 2
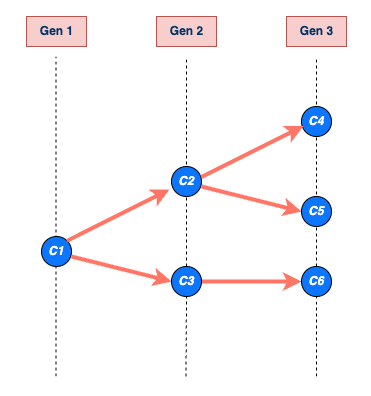
Exemple d’une chaîne de transmission
commençant par un seul cas C1. Les cas sont représentés par des
cercles bleus et des flèches indiquant qui a infecté qui. La chaîne se
développe à travers les générations Gen 1, Gen 2 et Gen 3, produisant
les cas C2, C3, C4, C5 et C6. La chaîne se termine à la génération Gen 3
avec les cas C4, C5 et C6. La taille de la chaîne de C1 est de 6, y
compris C1 (c’est-à-dire la somme de tous les cercles bleus), et sa
longueur est de 3, ce qui inclut la génération 1 (nombre maximal de
générations atteint par la chaîne de C1) (Azam
& Funk, 2024).
Figure 3

Schéma de la relation entre les différentes
périodes de transmission entre un infecteur et un infecté dans une paire
de transmission. La fenêtre d’exposition est définie comme l’intervalle
de temps au cours duquel se produit l’exposition virale, et la fenêtre
de transmission est définie comme l’intervalle de temps pour la
transmission ultérieure par rapport à la durée de l’infection (Chung
Lau et al., 2021).
Figure 4
Figure 5
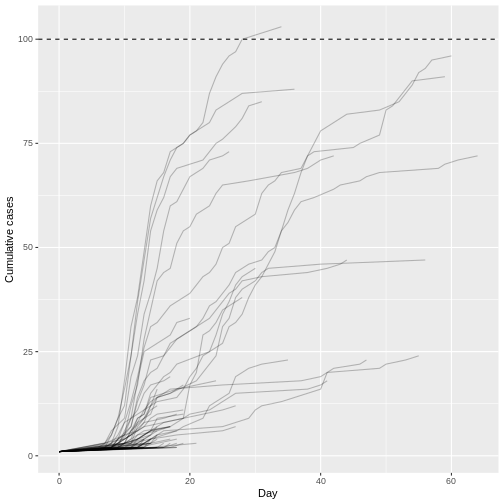
Figure 6
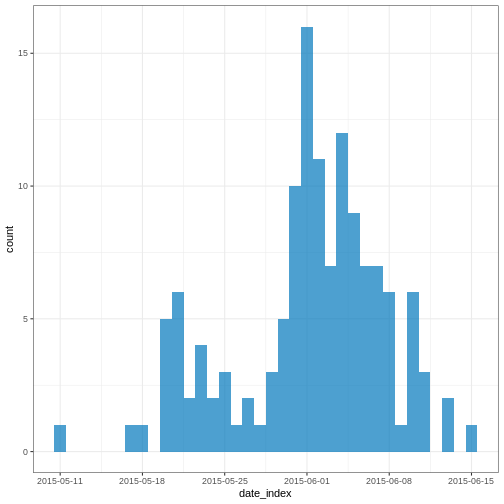
Figure 7
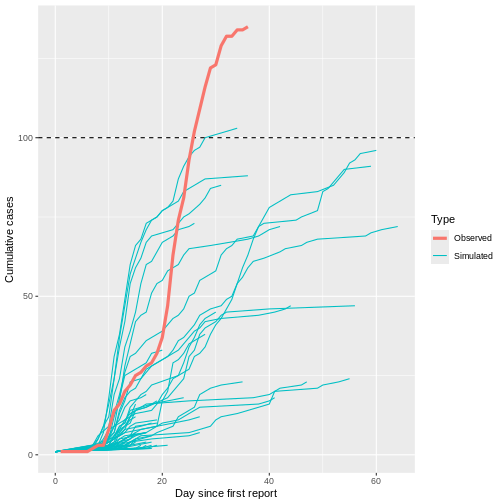
Figure 8
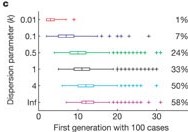
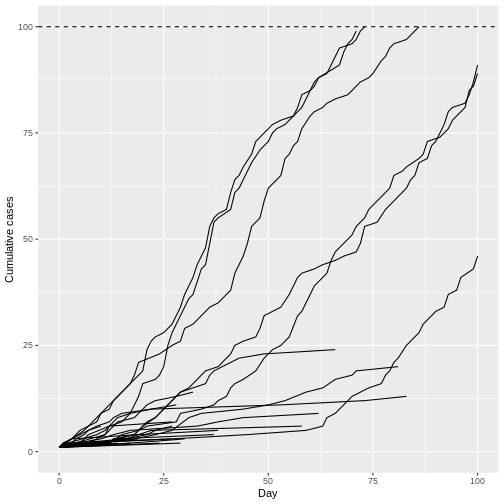
Croissance des épidémies avec R = 1,5 et
un cas initial, conditionné à la non-extinction. Les cadres
indiquent la médiane et l’écart interquartile (EQI) de la première
génération de maladie avec 100 cas ; les moustaches indiquent les
valeurs les plus extrêmes dans un rayon de 1,5 × EQI des cadres, et les
croix indiquent les valeurs aberrantes. Les pourcentages indiquent la
proportion de 10 000 foyers simulés qui ont atteint le seuil de 100 cas
(Lloyd-Smith et
al., 2005).
Figure 9
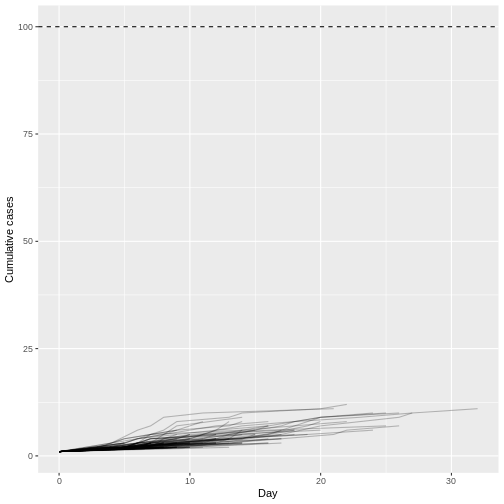
Figure 10
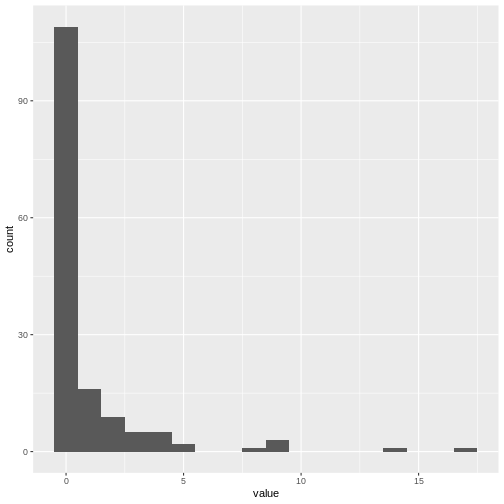
Figure 11